Процесс - восстановление - анион
Cтраница 1
Процесс восстановления анионов отличается специфическими особенностями, так как поверхность электрода заряжена отрицательно. Многие анионы, например NCXj, NO -, BrO -, JCXJ -, восстанавливаются в присутствии однозарядных катионов при очень отрицательных потенциалах. При прибавлении в раствор поливалентных катионов ( Са2, La3, Th4) потенциал их восстановления сдвигается к более положительным значениям и реакция идет с большей скоростью. Это особенно отчетливо наблюдается при восстановлении S2Og - на ртутном капельном электроде ( см. стр. При этом, если процесс не начинается до достижения потенциала нулевого заряда, то он либо совсем не протекает, либо протекает при очень отрицательных потенциалах. Если же процесс восстановления начинается до достижения потенциала нулевого заряда, то, после того как этот потенциал достигнут, вместо сил притяжения между поверхностью электрода и анионами начнут действовать силы отталкивания и процесс может замедлиться или совсем прекратиться. [1]
Торможение процесса восстановления анионов на отрицательно заряженной поверхности катода было впервые подробно изучено Т. А. Крюковой [8] на примере катодного процесса восстановления ионов S2Os - на ртутном капельном электроде. [2]
Между процессами восстановления аниона персульфата и аниона феррицианида имеется существенная разница: в Первом случае происходит разрыв связи О-О, в то время как во втором процесс сводится к изменению знака заряда иона без изменения его координационной сферы. [4]
Подробные исследования процесса восстановления анионов показали, что в уравнениях электрохимической кинетики необходимо учитывать не среднее для всего двойного электрического слоя значение оргпотенциала, а то его значение, которое устанавливается в месте восстановления аниона. Катионы металла, адсорбируясь на отрицательно заряженной поверхности электрода, уменьшают абсолютную величину отрицательного значения фрпотенциала. Это облегчает приближение анионов к поверхности электрода из-за образования катионных мостиков. Следовательно, предположение об образовании катионных мостиков в определенной степени подтверждает современные представления о строении двойного электрического слоя. [5]
Подробные исследования процесса восстановления анионов, проведенные А. Н. Фрумкиным и его школой, показали, что в уравнениях электрохимической кинетики необходимо учитывать не среднее для всего двойного электрического слоя значение ipi - потенциала, а локальное значение, устанавливающееся в месте, где происходит разряд аниона. Это облегчает приближение анионов к поверхности электрода и проявляется как образование катионных мостиков. [6]
Как показала Т. А. Крюкова, процесс восстановления аниона персульфата на ртути сильно тормозится, если потенциал ртути достигнет значения близкого или более отрицательного, чем потенциал нулевой точки. [7]
Помимо выделения водорода, на катоде протекают процессы восстановления анионов С1О - и СЮз, поступающих в катодное пространство вместе с анолитом через диафрагму. [8]
Так, в работе [61] на основании данных [62] утверждается о постепенном уменьшении числа электронов от 2 до 0 5 в процессе восстановления анионов бромуксусной кислоты при переходе от потенциалов на предельном токе волны к потенциалам у ее подножья. Снижение числа электронов в указанных работах объяснено сложным взаимодействием промежуточно образующегося радикала - СН2СОО - с исходным анионом и последующей димеризацией полученного продукта до соединения, содержащего четыре остатка исходного аниона бром-уксусной кислоты. По нашему мнению, однако, это явление объясняется тем, что при потенциалах, отвечающих подножию волны восстановления анионов бромуксусной кислоты, происходит образование ( в результате взаимодействия этих анионов со ртутью электрода) и последующее восстановление ртутьорганических соединений. [9]
В присутствии поверхностноактивных катионов ускоряется восстановление анионов ( см. гл. Ускорение процесса восстановления анионов в присутствии поверхностно-активных катионов было изучено А. Он также рассчитал форму i - / - кривой с учетом концентрационной поляризации. Было рассмотрено только ускорение, обусловленное сдвигом - потенциала; торможение, возможное при высокой степени заполнения, не рассматривалось. [11]
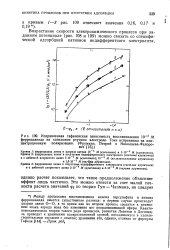
Катодное восстановление анионов сопровождается специфическими для этого процесса затруднениями - спадами тока. На рис. 96 приведена i-ф-кривая для электрода в разбавленном пирофосфатном медном комплексном растворе. Как видно из рисунка, при потенциале несколько более отрицательном, чем 0 05 в, ток резко уменьшается и процесс восстановления анионов СиР2О - тормозится. Такой эффект может быть объяснен пересечением i-ф-кривой потенциала нулевого заряда и вызывается появлением сил отталкивания, которые возникают между отрицательно заряженной поверхностью металла и анионами. [12]
На полярограммах Hg ( CN -) при отрицательных зарядах поверхности ртути имеется минимум, который постепенно исчезает при увеличении ионной силы и особенно валентности катионов фона. При этом потенциале начинается резкий спад силы тока. Все это характерно для описанных А. Н. Фрумкиным и Г. М. Флорианович процессов восстановления анионов. [13]
Совершенно неизменной остается и часть кривой при ф 1 3 в, отвечающая полной пассивации и выделению кислорода. Только добавление к серной кислоте 0 25 моль / л К2Сг207 приводит к небольшому снижению плотности тока на горизонтальном участке. При Ф 1 3 в наблюдается восстановление как бихромат -, так и перман-ганат-ионов, приводящее сначала к уменьшению суммарного анодного тока, а затем к изменению его знака и появлению катодного участка. Это сопровождается появлением в растворе Сг 3 и Мп2, причем никаких видимых изменений электродной поверхности не наблюдается. Процессы восстановления анионов не влияют на Фладе-потенциал ( 0 58 в), отвечающий началу пассивации. Кривые 3 и 5 на рис. 7 и 8, соответствующие повышенным концентрациям добавок, начинаются от потенциалов 0 9 - 1 2 е, так как в этих растворах железо пассивируется самопроизвольно. [14]
Гипотеза о роли ортоанионов в процессе восстановления N03, Br03, J0g, выдвинутая А. Н. Фрумкиным и С. И. Ждановым, кажется неправдоподобной. Легко можно вычислить, что скорость реакции возникновения ортоанионов, предшествующей собственно электродной стадии, должна быть невероятно большой, и поэтому мгновенным должен быть изотопный обмен кислорода, например в анионе N0 - что не наблюдается на опыте. Опыт показывает, что в этом растворе волна N03 сильно сдвинута в сторону более отрицательных потенциалов. Добавка буфера, препятствующего осаждению La ( OH) 3, вызывает рост перенапряжения восстановления N0 на 300 - 350 мв. В связи с этим мне хочется сказать, что А. Н. Фрумкин но делает всех выводов из своей теории замедленного разряда. Мне кажется, что автокаталитическое ускорение процесса может быть связано с дальнейшим ростом фх-потенциала в процессе восстановления анионов, фх-потенциал зависит от влапмодойствия катионов и анионов па поверхности электрода. [15]
Страницы: 1