Процесс - восстановление - ион - металл
Cтраница 1
Процесс восстановления ионов металла до нулевой валентности является одной из основных стадий получения металлсодержащих редокситов, получивших наибольшее распространение. [1]
Нередко процесс восстановления ионов металла при постоянном потенциале ускоряется в присутствии восстановителя; это показывает, что последний является не только источником электронов, но оказывает и специфическое активирующее воздействие на катодный процесс, возможно путем непосредственно химического взаимодействия. Поэтому следует полагать, что в ходе каталитического процесса наряду с электрохимическими протекают и чисто химические реакции. Экспериментальные данные показывают, что при химическом никелировании анодное окисление гипофосфита лимитируется гетерогенной химической реакцией. [2]
Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате которого получаются металлы в свободном виде. [3]
Рассмотрим соотношения между плотностью тока и потенциалом электрода, если замедленной стадией процесса восстановления ионов металла является их доставка к поверхности электрода. Процесс доставки участвующих в реакции ионов или молекул к электроду осуществляется диффузией, миграцией и конвекцией. [4]
Блокируя поверхность инертного либо свежеосажденного ме: талла, органические молекулы сильно замедляют процесс восстановления иона металла. [5]
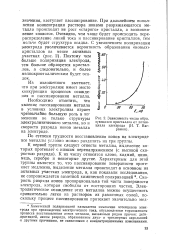 |
Зависимость числа образующихся кристаллов от потенциала электрода ( Н. Т. Ваг-рамян. [6] |
Химической поляризацией называется изменение потенциала электрода при прохождении электрического тока, обусловленное торможением процесса восстановления ионов металла, вызванным рядом причин: дегидратацией, актом разряда, образованием двух - и трехмерных зародышей и другими причинами, не связанными с концентрационными изменениями. [7]
 |
Катодные процессы в водных растворах солей. [8] |
Если катион электролита находится в ряду напряжений после водорода, то на катоде идет только процесс восстановления ионов металла. [9]
В комплексах металлов гемолитический разрыв связи и второй тип гетеролитического разрыва связи, когда электронная пара остается на металле, могут рассматриваться как процессы восстановления иона металла. [10]
Сульфаматные электролиты мало устойчивы, сложны в приготовлении, и на практике их используют сравнительно мало. Процесс восстановления ионов металлов из этих электролитов происходит с довольно высоким выходом по току, поэтому можно получать покрытия при повышенных плотностях тока. Присутствие в электролите ионов хлора в ряде случаев улучшает режим работы ванны, поэтому хлориды часто используют вместе с другими анионами, такими как сульфаты и сульфаматы в смешанных сульфат-хлоридных электролитах. [11]
Теория деполяризации электрода при сплавообразовании исходит из предположения, что электродный процесс протекает без кинетических затруднений. Облегчение процесса восстановления ионов металлов при образовании твердых растворов связано с изменением парциальной свободной энергии ( АФ) компонентов в сплаве. В зависимости от содержания компонентов в сплаве изменение ДФ будет равно АФ ( X - 1) / Хис л RT 1пХ, где X - молярная доля компонента и Uona - интегральная теплота смешения. [12]
Кроме того, влияние перемещающихся адсорбированных частиц на торможение процесса восстановления ионов металла будет значительно меньше, чем в случае неподвижных частиц. [13]
Эти ионы полностью сольватированы в растворе, и молекулы воды или другие лигандные группы заполняют координационную ячейку вокруг атомов металла. Реакции неорганического изотопного обмена показывают, что окисление и восстановление этих ионов часто происходит не прямым переносом электронов, а переносом атомов между лигандами [11], и поэтому в процессе восстановления иона металла до его низшей валентности может принимать участие лигандная группа. [14]
Изучение влияния природы подкладки при восстановлении ионов металла на твердых электродах затруднено по той причине, что, начиная с момента включения тока при выделении металла, природа подкладки изменяется и процесс восстановления ионов металла происходит как на чужеродной, так и на одноименной подкладке. Особенно наглядно решающая роль влияния природы подкладки на поляризацию выявляется при разряде ионов водорода. [15]
Страницы: 1 2