Процесс - электролитическое восстановление
Cтраница 1
Процессы электролитического восстановления и окисления применяются во многих областях промышленной химии: процессы электролитического восстановления, - главным образом, в органической химии, а процессы электролитического окисления - в неорганической. [1]
 |
Схема включения приборов при получении анилина. [2] |
Процесс электролитического восстановления нитробензола является весьма интересным и характерным примером применения электролиза в органической химии. [3]
Если процесс электролитического восстановления р-нитробензальдегида ведется больше 4 час. [4]
Описание процесса электролитического восстановления нитробензола в щелочной среде приведено на стр. Там же отмечается большое влияние, которое оказывает на ход процесса материал катода. [5]
Ход процесса электролитического восстановления нитробензола будет совершенно иным в зависимости от того, будет ли процесс протекать в щелочной или кислой среде. [6]
В патенте СМ [26] описан процесс электролитического восстановления малеиновой кислоты в растворе бензолсульфокислоты. [7]
Разнообразие факторов, оказывающих влияние на процесс электролитического восстановления, позволяет весьма точно его регулировать и получать из одного и того же сырья различные продукты. [8]
При данном значении потенциала электрода скорость процесса электролитического восстановления ( или окисления) обычно растет с увеличением концентрации разряжающихся частиц. Однако такая простая зависимость наблюдается не всегда. В кинетических уравнениях, описывающих реакции электровосстановления ( или электроокисления), концентрации исходных веществ могут входить со степенями, большими единицы, равными нулю или правильной дроби. В уравнения, описывающие кинетику электровосстановления органических соединений, их объемная концентрация входит обычно в дробной степени. [9]
Она с успехом применяется для ряда процессов электролитического восстановления и окисления трудно растворимых в водных средах органических веществ, так как позволяет осуществлять хорошее перемешивание во внутреннем, закрытом со всех сторон, катодном пространстве. [10]
При данном значении потенциала электрода скорость процесса электролитического восстановления ( или окисления) обычно растет с увеличением концентрации разряжающихся частиц. Однако такая простая зависимость наблюдается не всегда. В кинетических уравнениях, описывающих реакции электровосстановления ( или электроокисления), концентрации исходных веществ могут входить со степенями, большими единицы, равными нулю или правильной дроби. В уравнения, описывающие кинетику электровосстановления органических соединений, их объемная концентрация входит обычно в дробной степени. [11]
При данном значении потенциала электрода скорость процесса электролитического восстановления или окисления обычно растет с увеличением концентрации разряжающихся частиц. Это видно, например, из рис. 77, на котором представлены данные электровосстановления ионов трехвалентного марганца до его двухвалентных ионов. Однако такая простая зависимость наблюдается не всегда. [12]
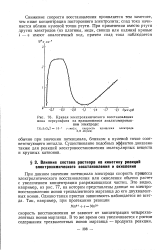 |
Кривая электрохимического восстановления. [13] |
При данном значении потенциала электрода скорость процесса электролитического восстановления или окисления обычно растет с увеличением концентрации разряжающихся частиц. Это видно, например, из рис. 77, на котором представлены данные по электровосстановлению ионов трехвалентного марганца до его двухвалентных ионов. Однако такая простая зависимость наблюдается не всегда. [14]
При данном значении потенциала электрода скорость процесса электролитического восстановления ( или окисления) обычно растет с увеличением концентрации разряжающихся частиц. Это видно, например, из рис. 86, на котором представлены данные по электровосстановлению трехвалентных ионов марганца до двухвалентных. Однако такая простая - зависимость наблюдается не всегда. В кинетических уравнениях, описывающих реакции электровосстановления ( или электроокисления), концентрации исходных веществ могут входить со степенями, большими единицы, равными нулю или правильной дроби. Один из таких примеров был приведен на стр. В уравнения, описывающие кинетику электровосстановления органических соединений, их объемная концентрация входит обычно в дробной степени. [15]
Страницы: 1 2