Процесс - горение - углеводород
Cтраница 1
Процесс горения углеводородов представляет собою их окисление кислородом воздуха, протекающее с очень большой скоростью, до конечных продуктов реакции - в основном воды и углекислого газа. Среди продуктов неполного сгорания могут быть очень малые количества СО, Н2, СН4 и твердые частицы, состоящие почти нацело из углерода. Температура горения углеводоро-до-воздушных смесей превышает 2000 СС. [1]
Аналогичные исследования проведены для процессов горения углеводородов. [2]
Светимость факела резко возрастает при появлении в нем частичек углерода, которые могут быть внесены в него извне или образованы в самом факеле в процессе горения углеводородов. [3]
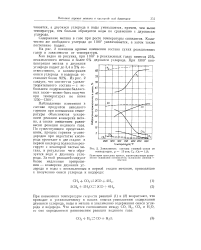 |
Зависимость состава газовой смеси от температуры, р 15 эти. С. Oz - 1 9. [4] |
Наблюдаемые изменения в составе продуктов неполного горения при повышении температуры объясняются ускорением реакции конверсии мета - на, а также смещением равно - f 15 весия реакции водяного газа. По существующим представлениям, процесс горения углеводородов при недостатке кислорода протекает в две стадии: в первой кислород полностью реагирует с некоторой частью метана, в результате чего образуется вода и двуокись углерода. [5]
При изучении горения окиси углерода в кислороде и более позднем исследовании химизма горения метана было показано, что обе эти реакции во многом аналогичны по своему механизму реакции горения водорода. Поэтому в настоящее время принято считать, что характеристики водородного пламени можно использовать и для процессов горения углеводородов. [6]
При диффузионном горении и горении гомогенных ( предварительно перемешанных) смесей с участием органических соединений протекают сложные химические процессы. В пламенах предварительно перемешанных смесей и в диффузионных пламенах органических соединений ( не содержащих в своем составе кислорода) отсутствуют окисленные углеводороды. Это свидетельствует о том, что процесс горения углеводородов отличается от предложенных в литературе схем низкотемпературного окисления этих соединений. Подобное предположение высказано еще в работе [21] при анализе результатов исследования диффузионного пламени парафиновой свечи. [7]
По температурным кривым на рис. 46 заметно, что ширина горячей зоны в пласте увеличивается по пути движения, очевидно, вследствие более быстрого движения фронта. Конвективный перенос фронта осуществляется продуктами горения и парами остаточной нефти и воды, теплоемкость и вес которых больше, чем исходной горючей смеси. Кроме этого, при переходе через фронт горячей зоны конденсируются пары воды, образовавшейся в процессе горения углеводородов. Расширение горячей зоны приводит, с одной стороны, к повышению расхода тепла на тепловую обработку пласта, а с другой стороны, - г - к ускорению темпов обработки; последнее сказывается положительно на экономике процесса. [8]
Для этого перекрывают кран 36 на сообщение трубки 18 с сосудом 5, заполненным раствором едкого кали. Первое прокачивание газа делают медленно, как это указано для сжигания водорода. Все последующие прокачивания проводят с обычной скоростью. Образующийся в процессе горения углеводородов углекислый газ тотчас же поглощается раствором едкого кали. Прокачивание повторяют до постоянства объема, после чего печь выключают и снимают с трубки. Последнюю охлаждают влажным полотном до комнатной температуры. Чтобы освободить газ от кислорода, который мог выделиться в результате термического разложения окиси меди, его вновь прокачивают через охлажденную трубку, затем через раствор пирогаллола и замеряют его объем. Уменьшение объема газа принимают за объем суммы предельных углеводородов. [9]
Из будущих применений спектроскопии к вопросам горения следует особо выделить изучение динамики процесса. Весьма вероятно, что очень существенными окажутся вопросы о деталях протекания столкновения, о зависимости вероятности осуществления данного элементарного акта от электронной конфигурации сталкивающихся частиц и о характере продуктов реакции. Мы уже видели, что молекулы С02, образующиеся при реакции нормальных молекул окиси углерода и атомов кислорода, первоначально находятся в возбужденном электронном состоянии и что даже после потери энергии электронного возбуждения молекула С02 сохраняет некоторый избыток колебательной энергии, который существенно влияет на весь процесс горения. Во всех насыщенных углеводородах и, вообще говоря, во всех органических соединениях углерод четырехвалентен, тогда как в СО и, вероятно, в GH, С2 и некоторых других радикалах он двухвалентен. Таким образом, в ходе процесса горения углеводородов атомы углерода до своего перехода в конечный продукт С02 могут несколько раз изменить свою валентность, что может усложнить механизм горения. Развитию работ в этом направлении должно предшествовать серьезное исследование электронных структур многоатомных молекул и взаимодействия между электронными конфигурациями различного типа. Большое количество статей, посвященных электронным структурам различных классов многоатомных молекул, было опубликовано за последние годы Мэлликеном ( в Phys. Следует надеяться, что эти результаты смогут быть со временем использованы для выяснения деталей кинетики процессов горения. [10]
Страницы: 1