Процесс - кислородная деполяризация
Cтраница 2
Как уже отмечалось, в продуктах коррозии в воде и водных растворах карбоновых кислот обнаружены гидроксиды металлов. Образование гидроксидов металлов характерно для всех водных конденсатов в нефтепродуктах вследствие развития процессов кислородной деполяризации и высокой подвижности ионов гидрок-сила. Наличие гидроксидов металлов в продуктах коррозии приводит к образованию их ассоциатов с карбонатами за счет образования водородной связи между протонирован-ным атомом водорода гидроксила и кислородом карбоксильной группы. [16]
При определенном смещении потенциала в отрицательную сторону на катоде может начаться какой-либо новый процесс. В водных растворах таким процессом обычно является разряд водородных ионов, при достижении обратимого потенциала которого в данном растворе ( Ун2) 0бРна процесс кислородной деполяризации начинает накладываться процесс водородной деполяризации [ кривая ( УН, ) обр GH, рис. 19 ] и общий процесс катодной деполяризации будет соответствовать кривой ( Уог) обр ACDEK ( рис. 19), которую называют общей кривой катодной поляризации. Эта кривая является характеристикой поведения данного металла в качестве катода. [17]
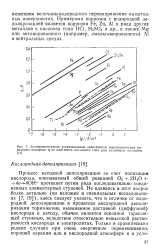 |
Экспериментально установленные зависимости перенапряжения выделения водорода 11 от плотности катодного тока для различных металлов. [18] |
Процесс катодной деполяризации за счет ионизации кислорода, описываемый общей реакцией Ог 2Н2О 4е - - 4ОН - протекает путем ряда последовательно соединенных элементарных ступеней. Не вдаваясь в этот вопрос более детально ( он изложен в специальных исследованиях [7, 19]), здесь следует указать, что в отличие от водородной деполяризации в процессах кислородной деполяризации торможение, вызываемое доставкой ( диффузией) кислорода к катоду, обычно является основной тормозящей ступенью, вследствие относительно невысокой растворимости кислорода в электролитах. [19]
Защитная плотность тока для изолированных магистральных газопроводов не может являться надежным критерием защиты вследствие неизвестного распределения повреждений изоляции газопровода, определяющих фактическую площадь контакта металла с грунтом. Даже для неизолированной трубы ( патрон на подземном переходе газопровода через железные и шоссейные дороги) защитная плотность тока, определенная расчетом по геометрическим размерам сооружения, является фиктивной, так как остается неизвестной доля поверхности патрона, покрытая постоянно присутствующими пассивными защитными слоями ( окалиной и др.) и не участвующая в процессе кислородной деполяризации. Поэтому защитная плотность тока как критерий защиты применяется при некоторых лабораторных исследованиях, выполняемых на образцах металла. [20]
Защитная плотность тока для изолированных магистральных газопроводов не может стать надежным критерием защиты вследствие неизвестного распределения повреждений изоляции газопровода, определяющих фактическую площадь контакта металла с грунтом. Даже для неизолированной трубы ( патрон на подземном переходе газопровода через железные и шоссейные дороги) защитная плотность тока, определенная расчетом по геометрическим размерам сооружения, является фиктивной, так как остается неизвестной доля поверхности патрона, покрытая постоянно присутствующими пассивными защитными слоями ( окалиной и др.) и не участвующая в процессе кислородной деполяризации. [21]
Толщина кислородных слоев в присутствии ионов Си2 уменьшается по мере повышения концентрации. В растворе сульфата натрия, образующего более толстые слои, процесс деполяризации иона Си2 оказывает меньшее влияние на скорость коррозии. Процесс кислородной деполяризации оказывает решающее влияние в случаях раствора нитрата калия, образующего пять атомных слоев, и карбоната натрия, образующего около 13 атомных слоев. [22]
 |
Равномерная пароводяная коррозия с появлением трещин.| Поляризационная диаграмма коррозионного процесса с кислородной поляризацией. [23] |
При высокой же концентрации кислорода только часть его успевает восстанавливаться, в то время как другая часть пассивирует металл в результате адсорбации на его поверхности. Развитие коррозионного процесса с кислородной деполяризацией при 292 и 350 С должно происходить с раз личной скоростью при условии, что контролирующей стадией является реакция ионизации молекул Оз. На рис. 4.2 показана типовая диаграмма процесса кислородной деполяризации для этого случая. [24]
Из проведенных экспериментов видно, что платинированный титан при катодной и анодной поляризации обладает свойствами, мало в чем уступающими свойствам платиновых электродов. То же справедливо и по отношению к процессу кислородной деполяризации. [25]
Автор связывает это с тем, что эти металлы не одинаково эффективно работают в качестве катодов. Окислы меди легко восстанавливаются и процесс ионизации кислорода протекает на чистом медном катоде. Окислы же хрома восстанавливаются с трудом, и поэтому процесс кислородной деполяризации протекает, по существу, на окисленном электроде, который не благоприятствует протеканию этой реакции. Очевидно, причины здесь более сложные; известно, что перенапряжение для реакции восстановления кислорода на ряде окисленных металлов ниже, чем на чистых. Кроме того, возможно, что более сильное влияние медного контакта связано с вторичным осаждением меди на алюминии. [26]
При определенном смещении потенциала в отрицательную сторону на катоде может начаться какой-либо новый процесс. В водных растворах таким процессом обычно является разряд водородных ионов, обратимый потенциал которого более чем на 1 В отрицательнее обратимого потенциала процесса ионизации кислорода. При достижении обратимого потенциала водородного электрода в данном растворе ( Кн2) обР на процесс кислородной деполяризации начинает накладываться процесс водородной деполяризации [ кривая ( Ун2) обРСЯ на рис. 159 ] и общий процесс катодной деполяризации будет соответствовать кривой ( Vo2) 06p ACDEK на рис. 159, которую называют общей кривой катодной поляризации. [27]
Процесс коррозии большинства металлов в растворах солей протекает с кислородной деполяризацией, а потому существенное влияние на скорость и характер коррозии оказывает растворимость продуктов коррозии. Если при действии раствора соли на металл и на катодных и на анодных участках образуются растворимые продукты коррозии, скорость коррозии не меняется. Если на анодных участках образуются растворимые продукты коррозии, а на катодных нерастворимые, процесс коррозии несколько замедляется, так как затрудняется доступ кислорода к катодным участкам, а следовательно происходит замедление процесса кислородной деполяризации. Образование нерастворимых продуктов коррозии на анодных участках металла вызывает резкое замедление процесса коррозии. Еще большее замедление процесса коррозии наблюдается при действии на металл растворов солей, способствующих образованию на поверхности металла нерастворимой в электролите сплошной защитной пленки. [28]
Коррозия с образованием неравномерно распределенных язв характерна для листового нелегированного цинка в холодной и горячей воде и в растворах солей. Язвы располагаются преимущественно под отложениями продуктов коррозии. При коррозии в горячей воде образуются белые чашеобразные отложения вокруг газовых пузырьков. Этот вид коррозии наблюдается на катодных участках с небольшим значением перенапряжения выделения водорода при наложении процесса кислородной деполяризации. [29]
Химический состав водорастворимых составляющих пока не является достаточно эффективным для оценки агрессивности почвы. Установить зависимость коррозионной активности от присутствия тех или других ионов не удается. Однако известно, что наиболее агрессивными составляющими почвы являются хлориды и сульфаты. Так как эти соли почти всегда имеются в почве в известном количестве, их присутствие не может служить показателем коррозионной активности. В результате анализа многочисленных данных удалось установить [10], что содержание ионов С1 - и SOr свыше 0 1 % часто сопровождается повышением коррозионной активности почвы. Однако и противоположные случаи были слишком часты, поэтому определенных выводов сделать нельзя. Это объясняли тем, что соли способствуют влагоудержанию почвы и этим предохраняют ее от растрескивания. В результате затрудняется доступ к металлу воздуха, кислород которого нужен для процесса кислородной деполяризации. [30]
Страницы: 1 2