Катодный процесс - восстановление - кислород
Cтраница 1
Катодный процесс восстановления кислорода состоит из нескольких стадий. [1]
Мокрая атмосферная коррозия является электрохимической коррозией с катодным процессом восстановления кислорода. Скорость коррозии может быть больше, чем в условиях полного погружения в электролит, в связи с диффузией кислорода через пленку влаги к металлу. Электролитом при атмосферной коррозии являются как сама влага, так и увлажненный слой продуктов коррозии. Облегченность диффузии кислорода, с одной стороны, приводит к ускорению катодной реакции, а с другой - может вызвать пассивацию металла. При малых толщинах пленок заметно возрастает омическое сопротивление. [2]
Перемешивание сильно увеличивает ток элемента лишь в весьма узких зазорах, что обусловлено ускорением катодного процесса восстановления кислорода на поверхности, к которой имеется свободный доступ кислорода. Перемешивание электролита в узких зазорах практически невозможно, и поэтому анодное растворение при кислородном голодании протекает легко. В относительно широких зазорах перемешивание увеличивает доступ кислорода как в зазор, так и к поверхности, свободно омываемой электролитом. Вероятность возникновения активно-пассивных элементов при этом уменьшается, эффективность их работы падает. Таким образом, можно заключить, что в узких зазорах щелевая коррозия в перемешиваемых электролитах будет протекать весьма интенсивно. [3]
Перемешивание сильно увеличивает ток элемента лишь в весьма узких зазорах, что обусловлено ускорением катодного процесса восстановления кислорода на поверхности, к которой имеется свободный доступ кислорода. Перемешивание электролита в узких зазорах практически невозможно, и поэтому анодное растворение при кислородном голодании протекает легко. В относительно широких зазорах перемешивание увеличивает доступ кислорода как в зазор, так и к поверхности, свободно омываемой электролитом. Вероятность возникновения активно-пассивных элементов при этом уменьшается, эффективность их работы падает. Таким образом, можно заключить, что в узких зазорах щелевая коррозия в перемешиваемых электролитах будет протекать весьма интенсивно. [4]
При большом разнообразии природных вод от чистых деминерализованных источников, речной и морской воды до подземных вод из геотермальных скважин с содержанием солей до 100 г / л и с температурой до 200 - 250 С коррозия металлов в большинстве случаев протекает по электрохимическому механизму с катодным процессом восстановления кислорода. [5]
При нарушении по той или иной причине пассивного состояния стали в бетоне создаются условия для более или менее свободного протекания анодного процесса растворения металла. Контролирующим может оказаться катодный процесс восстановления кислорода, который, в свою очередь, йудет лимитироваться диффузией кислорода через защитный слой бетона. При малой влажности бетона его ионная проводимость весьма мала, и решающее значение приобретает, очевидно, омический контроль коррозионного процесса. [6]
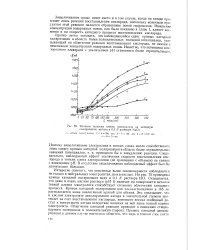 |
Влияние толщины пленки электролита на катодную поляризацию магния в 0 1 jV растворе NaCl. [7] |
Защелачивание среды имеет место и в том случае, когда на катоде протекает лишь реакция восстановления кислорода, поскольку конечным продуктом этой реакции является образование ионов гидроксила. Изменение концентрации водородных ионов, как было показано в главе I, влияет косвенно и на скорость катодного процесса восстановления кислорода. [8]
На рис. 47 представлены поляризационные кривые для ИКБ-4, снятые в потенциостатическом режиме. С ростом концентрации ИКБ-4 в агрессивной среде он начинает активно вмешиваться в оба электродных процесса, однако несколько больше в катодный процесс восстановления кислорода, о чем свидетельствует небольшой сдвиг стационарного потенциала в отрицательную сторону. [9]
Почва и грунт содержат различные химические реагенты, влагу и обладают ионной электропроводностью. Это делает их корро-зионноактивными средами по отношению к металлическим конструкциям. В подавляющем большинстве случаев подземная коррозия происходит по электрохимическому механизму с катодным процессом восстановления кислорода при диффузионном контроле. Перенос кислорода к поверхности металла осуществляется течением газообразной или жидкой фаз, конвективным перемешиванием этих фаз или диффузией кислорода в газообразной или жидкой фазе. [10]
 |
Зависимость потенциала и истинной скорости коррозии стали в 0 1 н. Na2S04 от концентрации бората натрия. [11] |
Слабое изменение потенциала в широкой области концентраций NaB03, сопровождающееся увеличением скорости коррозии, требует специального исследования. Оно может наблюдаться в случае, когда ингибитор ускоряет одну из коррозионных электродных реакций или обе сразу в одинаковой степени. Судя по тому, как этот ингибитор частично пассивирует электрод ( см. рис. 2 17), эффект от увеличения эффективности обычного катодного процесса восстановления кислорода невелик. Поэтому не исключено, что NaB03 оказывает непосредственное влияние на кинетику катодной реакции, участвуя в процессе деполяризации. При больших концентрациях ингибитора ( 0 1 моль / л) наступает резкий сдвиг потенциала в анодную сторону, который сопровождается падением скорости коррозии. Это однозначно указывает на замедление ингибитором анодной реакции. [12]
Исследование реакции восстановления этого ингибитора на железном катоде в буферном электролите показало, что он не восстанавливается в нейтральных электролитах на железе. Поэтому увеличение истинной скорости растворения стали малыми концентрациями вольфрамата объясняется ростом эффективности катодного процесса восстановления кислорода, а не ингибитора. [13]
Страницы: 1