Обратимый необратимый процесс
Cтраница 1
Обратимые и необратимые процессы могут быть составлены из последовательности равновесных или неравновесных состояний рассматриваемой физической системы. [1]
Обратимые и необратимые процессы имеют определенные свойства, позволяющие отличать одни процессы от других. Условиями обратимости процесса являются: бесконечно медленное изменение состояния тела, прохождение системы в процессе только через равновесные состояния, отсутствие в системе всякого трения и отсутствие процесса сгорания. Есл в процессах все эти условия или некоторые из них отсутствуют, то такие процессы становятся необратимыми. [2]
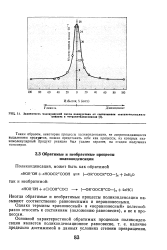 |
Зависимость нолекулярной массы полиуретана от соотношения гекеаметвлевднвэо цнаната в тетраметиленгликоля. [3] |
Иногда обратимые и необратимые процессы поликонденсации называют соответственно равновесными и неравновесными. [4]
Понятие обратимых и необратимых процессов является основным для термодинамики. Обратимыми называют процессы, протекающие с бесконечно малой скоростью, которые представляют собой как бы непрерывную смену равновесных состояний. Оно относится к основным понятиям классической термодинамики и является идеализированным представлением процессов, протекающих в естественных условиях. [5]
Динамика обратимых и необратимых процессов намагничивания и перемагничивания представляет собой столь сложное явление, что теоретическое рассмотрение возможно в настоящее время только для некоторых частных случаев и весьма упрощенных моделей. Ниже рассмотрена в качестве иллюстрации динамика движения доменной стенки в тонкой ленте с прямоугольной петлей гистерезиса и показано ее влияние на форму динамической петли гистерезиса. [6]
Чем отличаются обратимые и необратимые процессы. Почему все реальные процессы необратимы. [7]
Анализируя понятия обратимых и необратимых процессов, мы путем некоторых общих, но еще недостаточно убедительных рассуждений, подтвержденных примерами, показали, что неравновесность процесса является признаком и причиной его необратимости. Теперь мы имеем возможность строго доказать это утверждение. Вспомним прежде всего, что понятия обратимого и необратимого процессов относятся к абсолютно изолированной системе. [8]
Из определения обратимых и необратимых процессов следует, что работа, выполняемая системой при переходе из определенного начального состояния в определенное конечное состояние, в результате прохождения некоторого процесса в условиях, когда он является необратимым, заведомо меньше, чем когда этот процесс проводится в условиях, обеспечивающих его практическую обратимость. [9]
Различие между квазистатическими обратимыми и необратимыми процессами заключается в конечном счете в том, что квазистатические обратимые процессы представляют собой последовательную цепь равновесных состояний, в то время как необратимые процессы представляют собой цепь неравновесных состояний. [10]
Что подразумевается под обратимыми и необратимыми процессами. [11]
Сравнивая работу при изотермическом обратимом и необратимом процессе ( уравнения ( 15 10) и ( 34 7)) видим, что работа при изотермическом необратимом процессе меньше, чем при обратимом. [12]
В нее дают вклад обратимые и необратимые процессы намагничивания. Соответственно дифференциальная восприимчивость состоит из обратимой и необратимой восприимчивости. [13]
Как изменяется энтропия для обратимых и необратимых процессов. Чему равно значение JdQ / T для обратимого и необратимого кругового процесса. Температура каких тел входит в этих случаях в знаменатель подынтегрального выражения. [14]
В термодинамике существуют понятия обратимых и необратимых процессов. Обратимым называется процесс, после совершения которого в прямом, а затем в обратном направлении рабочее тело возвращается в свое первоначальное состояние без дополнительных затрат энергии. [15]
Страницы: 1 2 3 4