Изобарно-изотермический процесс
Cтраница 2
Неравенство (1.6) означает, что при необратимых изобарно-изотермических процессах термодинамический потенциал уменьшается. [16]
Эта одинаковость составов должна сохраняться в течение всего изобарно-изотермического процесса. Системы же с постоянно одинаковыми составами фаз могут, очевидно, рассматриваться как унарные. [17]
Процесс подвода теплоты 4 - / является изобарно-изотермическим процессом парообразования. Из котла сухой насыщенный пар с параметрами в точке 1 поступает в турбину. Пар, изоэнтропно расширяясь в турбине, производит работу ( линия 1 - 2) и превращается во влажный насыщенный пар. Затем пар поступает в конденсатор ( теплообменник), в котором за счет охлаждающей воды от пара при постоянном давлении р % отводится теплота ( линия 2 - 3), происходит частичная конденсация пара. Процесс отвода теплоты 2 - 3 является изобарно-изотермическим процессом. В схеме установки ( см. рис. 11.1) при рассмотрении цикла Карно насос заменяют компрессорам. Влажный пар с параметрами в точке 3 подается на прием компрессора и изоэнтропно сжимается с затратой работы ( линия 3 - 4), превращаясь в воду с температурой кипения. Затем кипящая вода подается в котел, и цикл замыкается. [18]
В частности, изобарная теплоемкость (13.21) в изобарно-изотермическом процессе и изохорная теплоемкость (13.22) в изохорно-изотермическом процессе принимают значения - оо при отводе теплоты и оо при подводе теплоты. [19]
Большое значение имеет рассмотрение вопросов равновесия в изобарно-изотермических процессах. [20]
Рассмотрим изобарно-изотермический потенциал как критерий равновесия при изобарно-изотермическом процессе. [21]
Таким образом, максимальная полезная работа при изобарно-изотермических процессах равна убыли изобарного потенциала. [22]
Таким образом, возможность, направление и предел течения изобарно-изотермических процессов в неизолированной системе определяются знаком разности AZ Z2 - Zlt а термодинамические возможности этого процесса - абсолютной величиной этой разности. [23]
Следовательно, изобарный тепловой эффект реакции ( протекающей при изобарно-изотермическом процессе) равен изменению энтальпии системы. [24]
Энергия Гиббса служит критерием самопроизвольного протекания химической реакции при изобарно-изотермических процессах. [25]
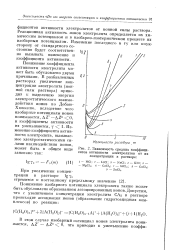 |
Зависимость средних коэффициентов активности электролитов от их концентрации в растворе. [26] |
Реакционная активность ионов электролита определяется их химическим потенциалом и в изобарно-изотермическом процессе их изобарным потенциалом. Изменение последнего в ту или иную сторону от стандартного состояния будет соответствен - g v но вызывать изменение и коэффициента активности. [27]
Таким образом, если для системы, в которой может совершаться изобарно-изотермический процесс, обусловленный химическими превращениями, известны значения Ф в зависимости от состава ( например, в функции концентрации вещества A - HAI, рис. 15 - 3), то все возможные состояния смеси реагентов на кривой Ф / ( nAi) для заданной температуры будут неравновесными, исключая точку R, соответствующую Фииа, и химическая реакция будет протекать с той или иной скоростью до тех пор, пока не будет достигнуто равновесное состояние R с минимальным значением изобарно-изотер-мического потенциала. [28]
Чтобы применить основные результаты, полученные в § 12.5 относительно направления изобарно-изотермического процесса и положения равновесия в системе при постоянных давлении и температуре, к системам, содержащим многокомпонентные фазы, нужно ввести понятие парциальной молярной энергии Гиббса. [29]
Изменение свободной энергии равно максимальной полезной работе, которую совершает система в изобарно-изотермическом процессе. [30]
Страницы: 1 2 3 4