Прочность - л-связь
Cтраница 1
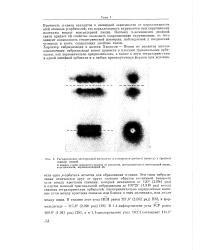 |
Распределение электронной плотности л-электронов двойной ( вверху и тройной ( внизу связей. [1] |
Прочность л-связи находится в очевидной зависимости от параллельности осей атомных р-орбиталей; эта параллельность нарушается при скручивании молекулы вокруг межъядерной линии. Поэтому л-компонента двойной связи придает ей свойство оказывать сопротивление скручиванию, от чего зависит возможность геометрической изомерии, наблюдаемой у соединений углерода и азота, содержащих двойные связи. [2]
Любое отклонение от копланарного состояния вследствие поворота вокруг о-связи, соединяющей два атома углерода, приведет к уменьшению степени перекрывания и соответственно к снижению прочности л-связи; система стремится, естественно, избежать таких отклонений. Появляется, таким образом, теоретическое оправдание для давно известного явления препятствия вращению вокруг двойной углерод-углеродной связи. Неудивительно поэтому, что реакции с такого рода соединениями наиболее характерны для двойной углерод-углеродной связи ( ср. [3]
Любое отклонение от копланарного состояния вследствие поворота вокруг о-связи, соединяющей два атома углерода, приведет к уменьшению степени перекрывания и соответственно к снижению прочности л-связи; система стремится, естественно, избежать таках отклонений. Появляется, таким образом, теоретическое оправдание для давно известного явления препятствия вращению вокруг двойной углерод-углеродной связи. Неудивительно поэтому, что реакции с такого рода соединениями наиболее характерны для двойной углерод-углеродной связи ( ср. [4]
Любое отклонение от копланарного состояния вследствие поворота вокруг ст-связи, соединяющей два атома углерода, приведет к уменьшению степени перекрывания и соответственно к снижению прочности л-связи; л-связь, таким образом, способствует сохранению плоскостности молекулы. В этом заключается теоретическое объяснение давно известного явления препятствия вращению вокруг двойной углерод-углеродной связи. Неудивительно поэтому, что реакции с такого рода реагентами наиболее характерны для двойной углерод-углеродной связи ( ср. Таким образом, классическая картина двойной связи заменяется моделью, согласно которой две связи, соединяющие атомы углерода, не только не идентичны, но и различны по природе, прочности и расположению в пространстве. [5]
Усиление склонности к полимеризации, высокие значения координационного числа и создают большое многообразие кислородных соединений этих элементов как в водных растворах, так и в конденсированном состоянии. Отмеченная выше наименьшая прочность л-связей у ХОГ анионов элементов IV периода приводит к появлению вторичной периодичности в физико-химических свойствах соединений этих элементов. Накопленный к настоящему времени обширный экспериментальный материал неплохо иллюстрирует приведенные выше теоретические прогнозы. [6]
Цианидные комплексы известны почти для всех переходных металлов d - группы, а также для соседних металлов Zn, Cd и Hg. Устойчивость цианидных комплексов в известной мере связана с прочностью л-связи металл - CN, и, как видно будет в дальнейшем, многие факты указывают на это. Однако способность группы CN к л-акцептированию, по-видимому, не столь велика, как у СО, NO или RNC, что объясняется наличием у этой группы отрицательного заряда. Ион CN - является сильным нуклеофилом, и устойчивость его комплексов с металлами в их обычных состояниях окисления ( например, II, III) едва ли можно объяснить при помощи представлений об образовании дативных связей. [7]
Так, например, в молекуле азота два атома связаны одной а - и двумя л-связями. Эти связи далеко не равноценны - во многих случаях прочность л-связи значительно уступает прочности а-связи. Вследствие этого при химических реакциях л-связи разрываются гораздо легче, чем с-свя. [8]
 |
Схематическое изображение электронного строения этилена ( разные формы изображения а - и я-связи. [9] |
О том, что две связи между атомами углерода не являются простым удвоением одинарной связи, свидетельствуют многие физические данные, например, длина связи, ее энергия и др. Как указывалось выше, длина простой связи С - С равна 1 54 А, а длина двойной связи С С - 1 34 А; энергия связи С - С равна 350 кДж / моль, а энергия двойной связи С С - 606 1 кДж / моль. Разница в 256 1 кДж / моль и является приблизительной мерой прочности л-связи. [10]
 |
Схемы молекулярных орбиталей молекул N2 н СО. [11] |
ОКСИД УГЛЕРОДА ( 1У) СО2 - диоксид углерода, углекислый газ - получается при сгорании любых углеродсодержащих веществ в избытке воздуха. Молекула С02 линейная с ковалентными кратными связями ОСО. Как и в оксидах азота, прочность л-связей в молекуле СО2 велика, и поэтому диоксид углерода не склонен к полимеризации. Этим он резко отличается от диоксидов других элементов 14 - й группы. Уже в случае кремния л-связи имеют заметно меньшую энергию, чем а-связи, и диоксид кремния образует атомную кристаллическую решетку, в которой атомы кремния имеют координационное число, равное 4, и образуют четыре а-связи, а все атомы кислорода являются мостиковыми. [12]
Следует обратить внимание, однако, на то, что сами по себе данные по изомеризации еще ни о чем не говорят, поскольку неизвестны энергии сольватации для каждой пары изомеров. Относительная устойчивость определяется энтропией сольватации. Так, транс-изомеры, обладающие ничтожно малыми дипольными моментами, менее полярны, менее сольватированы, а следовательно, и менее устойчивы. Поэтому, вообще говоря, выводы о прочности л-связи, сделанные на основании относительной устойчивости цис - и транс-изомеров, не имеют большой ценности. [13]
Он показал, что между рассматриваемым атомом металла и окружающими атомами металла осуществляется л-связь за счет частично заполненных d - орбита-лей металла. При обсуждении спектров карбонилов металлов ранее было показано, что заместители, которые не участвуют в образовании л-связи с атомом металла, повышают прочность л-связи между атомом металла и окисью углерода. [14]
Химия алкенов и циклоалкенов определяется в основном наличием связи С С, и три причины лежат в основе этого. Во-первых, относительно слабая и легко поляризуемая связь взаимодействует без труда как с электрофилами, так и со свободными радикалами, подвергаясь соответственно гетеролизу или гомолизу. Гетеролиз, естественно, сопровождается одновременным или последовательным взаимодействием катионного интерме-диата с анионом, в то время как гомолиз обычно сопровождается реакцией с атомом или радикалом, образующимся по радикальной реакции замещения. В обоих случаях конечный итог состоит в том, что осуществляется реакция присоединения, и атомы углерода, ранее участвовавшие в я-связи, теперь образуют две новые ст-связи, суммарная энергия которых намного превышает прочность л-связи. Во-вторых, связь С С может стабилизировать соседний радикальный, анионный или катионный центр за счет делокализации электронов и таким образом увеличивать реакционную способность молекулы по этому центру. Трехуглеродный фрагмент такого типа известен как аллиль-ная группа, и уже указывалось, что аллильный радикал и карбониевый ион являются относительно устойчивыми ( стр. В-третьих, геометрия связи С С, так же как строение интермедиатов в реакции, ориентирует общую направленность присоединения таким образом, что различные реакции такого рода для соответствующих замещенных алкенов проявляют ярко выраженную стереоспецифичность. Следует также отметить, что двойная связь как элемент структуры, положение которого в молекуле может изменяться, может являться причиной появления изомеров положения. Так, известны два изомера бутилена - бутен-1 и бутен-2, причем последний существует в виде цис - и горанс-изомеров ( ср. [15]
Страницы: 1 2