Проявление - металлические свойство
Cтраница 1
Проявление металлических свойств элементами VI группы наиболее ярко выражено у полония. В то время как сера является истинным непроводящим веществом ( уд. [1]
Проявление металлических свойств элементами VI группы наиболее ярко выражено у полония. В то время как сера является истинным непроводящим веществом ( уд. Полоний в каждой из двух аллотропных модификаций имеет сопротивление, свойственное истинным металлам ( - 43 цй-ом), и положительный температурный коэффициент. Низкотемпературная модификация, устойчивая до - 100, имеет кубическую структуру, а высокотемпературная - ромбоэдрическую. В обеих формах полоний проявляет координационное число шесть. [2]
Относительное значение каждой из этих составляющих и определяет характер проявления металлических свойств в твердом и жидком металле. Напротив, пар металла состоит из отдельных молекул ( обычно одноатомных) и ведет себя аналогично прочим газообразным веществам. Металлическая связь характерна, следовательно, только для твердого и жидкого состояний: она является свойством не отдельных частиц, а их агрегата. [3]
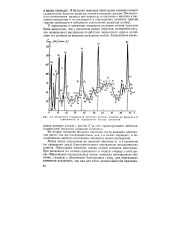 |
Изменение стандартной энтропии простых веществ по периодам в зависимости от порядкового номера элементов. [4] |
Малое число электронов во внешней оболочке d - и / - элементов ( не превышает двух) благоприятствует проявлению металлических свойств. Переходные элементы только отдают внешние электроны. При ионизации их атомов отрываются в первую очередь s - электро-ны. [5]
Когда верхние зоны сближаются вплотную или перекрываются, как, например, в случае элементов второй группы - кальция, бериллия и др. - мы снова встречаемся с проявлением металлических свойств. Таким образом, ширина, строение, степень заполнения зон и расстояние между ними - ширина запрещенной зоны - отражая электронную структуру, указывают на природу твердого вещества. [6]
Металлы состоят из большого числа атомов, и нетрудно отделить свойства, непосредственно связанные с химической связью между атомами, от свойств, которые обусловлены совокупностью атомов. Для проявления металлических свойств необходимо, чтобы объект, построенный из атомов, имел в поперечнике по меньшей мере 1 мкм. На сегодняшний день накоплено большое количество эмпирических сведений, касающихся свойств металлов, однако по отмеченным выше причинам отобрать среди них достоверные данные достаточно сложно. Ниже главное внимание уделяется сравнению элементов между собой. [7]
 |
Схема сдвига слоев при разных типах структур. [8] |
Уже приведенные в основном тексте примеры показывают, что действующие в металлах силы стяжения должны иметь сложную природу. Относительное значение каждой из этих составляющих и определяет характер проявления металлических свойств в твердом и жидком металле. [9]
 |
Упаковка ионов в кристалле NaCl.| Схема строения. [10] |
Уже приведенные примеры показывают, что действующие в металлах силы стяжения должны иметь сложную природу. Относительное значение каждой из этих составляющих и определяет характер проявления металлических свойств в твердом и жидком металле. Напротив, пар металла состоит из отдельных молекул ( обычно одноатомных) и ведет себя аналогично прочим газообразным веществам. Металлическая связь характерна, следовательно, только для твердого и жидкого состояний: она является свойством не отдельных частиц, а их агрегата. [11]
Кроме того, эти элементы присутствуют в виде небольших примесей в рудах различных металлов, например Си, Pb, Ag и Hg. Мышьяк и сурьма, подобно фосфору, проявляют аллотропию. Если быстро охлаждать нагретые до высокой температуры пары соответствующего элемента, оба элемента могут быть получены в виде мягких, желтых твердых веществ с неметаллическими свойствами. В результате нагревания или под воздействием света они переходят в серые формы с большим проявлением металлических свойств и теперь уже состоят не из молекул, а из атомных слоев. Для висмута более распространенной формой является красновато-белая, внешне похожая на металлическую. Этот элемент образует сплавы со многими металлическими элементами. Сплавы свинца, висмута и олова идут на изготовление легкоплавких заглушек в автоматических огнетушителях. При возникновении очага пожара заглушка расплавляется, и вода под давлением начинает разбрызгиваться в горящее помещение. [12]
 |
Кристаллы хлористого натрия. [13] |
Следовательно, молекулы фтористого лития более устойчивы, когда они построены так, что каждый атом лития расположен одновременно около нескольких атомов фтора: так же как и в металлах, атом со свободными орбитами более устойчив, если он окружен несколькими соседними атомами. Тогда электроны, удерживаемые соседними атомами, могут находиться одновременно около двух или более ядер. Но в данном случае имеется существенное отличие от металлов - в твердом фтористом литии половина атомов обладает высокой энергией ионизации. Атомы фтора прочно удерживают свои электроны. Поэтому в ионных кристаллах характерная для металлов подвижность электронов отсутствует. Это означает, что у ионных кристаллов нельзя ожидать проявления металлических свойств. Посмотрим, какие же свойства имеют эти вещества. [14]
Простые вещества - это обычно металлы или неметаллы. Однако большинство элементов отчетливо выражает свойства как тех, так и других, например сурьма, мышьяк, йод и др. Так, кислородные соединения мышьяка образуют кислоты, дающие с металлами соли. В различных состояниях валентности многие элементы особенно наглядно раскрывают свою двойственную природу. Аналогично и железо - двухвалентное дает катион, а шестивалентное - анион железной кислоты. Все это говорит о том, что металличность и неметалличность внутренне присущи и сочетаются в одном и том же элементе, веществе, но у некоторых одно из этих свойств выражено преимущественно, а у других они равносильны, и в зависимости от строения вещества, условий ( среды) и действующего реагента проявляется то или иное. Как известно, атомы состоят из положительно заряженного ядра и отрицательно заряженные электронов. Между ними действуют две противоположные силы: притяжение - между разноименными зарядами и отталкивание - между одноименными. Наличие и взаимодействие этих сил обеспечивает, во-первых, устойчивое существование атома, во-вторых, открывает возможность таких химических реакций, в процессе которых в зависимости от условий ( t, p и химической природы другого реагента) от атома отделяется или к нему притягивается то или иное количество электронов. Факты показывают, что проявление металлических свойств в простейшем виде связано с отдачей электронов, а неметаллических - с приобретением. [15]
Страницы: 1