Дигидрат - нитрат
Cтраница 1
Дигидраты нитратов цирконила и гафнила с небольшим количеством воды образуют гексагидраты ZrO ( NO3) 2 - 6H2O и НЮ ( МОз) 2 - 6Н2О, хорошо растворимые в воде. [1]
Было установлено, что прв & растворении дигидрата нитрата уранила в простых эфирах, кето-нах, дипропилсульфиде, ацетонитриле и нитрометане координированные молекулы воды образуют водородную связь с молекулами растворителя. [2]
По-видимому, с повышением температуры область существования гексагидрата нитрата магния сужается, а высаливание дигидрата нитрата магния наступает при более низких концентрациях азотной кислоты. [3]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 отвечает линии MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2Оз приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентрации от 0 до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [4]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 С отвечает липни MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2О5 приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентраций от О до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [5]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 С отвечает липни MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2О5 приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентраций от О до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [6]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 отвечает линии MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2Оз приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентрации от 0 до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [7]
При таком составе вытяжка может быть насыщена лишь двумя твердыми фазами - моно - и дикальцийфосфатом. Но этому составу соответствует исходная концентрация РгО5 20 7 %, при которой раствор фосфорной кислоты насыщен дигидратом нитрата кальция. [8]
В рассматриваемой системе изотермы характеризуются полями ( насыщения моно - дикальцийфосфатом, а также водным и безводным нитрато. Эти твердые фазы образуются не только в результате высаливания одних компонентов другими, но и в результате различных химических реакций - разложения фосфатов водой, взаимодействия между нитратом кальция и фосфорной кислотой, а также между фосфатами и азотной кислотой. Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 отвечает линии MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему P2Os приводит к уменьшению растворимости нитрата кальция. [9]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 С отвечает липни MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2О5 приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентраций от О до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [10]
Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 отвечает линии MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему Р2Оз приводит к уменьшению растворимости нитрата кальция. Отсюда следует, что в пределах концентраций от 0 до 29 2 % Р2О5 при 50 образуется раствор фосфорной кислоты, насыщенный дигидратом нитрата кальция. Соответственно при 25 в пределах концентрации от 0 до 36 1 % Р2О5 образуется раствор фосфорной кислоты, насыщенный четырехводным нитратом кальция. [11]
При дегидратации в вакууме при 60 гептагидрата сульфата железа ( П) [100] происходит непрерывная потеря воды и образуется аморфный моногидрат, удельная поверхность которого равна 9 4 мг-г-1. При дегидратации в закрытом сосуде появляется индукционный период, начало которого соответствует стадии образования тетрагидрата при 6 мм рт. ст. Это соединение, очевидно, менее чувствительно к низкому давлению водяного пара, чем дигидрат нитрата никеля; другие свойства этих двух соединений очень похожи. [12]
В рассматриваемой системе изотермы характеризуются полями ( насыщения моно - дикальцийфосфатом, а также водным и безводным нитрато. Эти твердые фазы образуются не только в результате высаливания одних компонентов другими, но и в результате различных химических реакций - разложения фосфатов водой, взаимодействия между нитратом кальция и фосфорной кислотой, а также между фосфатами и азотной кислотой. Область образования стабильных насыщенных растворов нитрата кальция и фосфорной кислоты на изотерме 50 отвечает линии MN, разделяющей поля дикальцийфосфата и дигидрата нитрата кальция. Точка М соответствует растворимости дигидрата нитрата кальция в воде; введение в систему P2Os приводит к уменьшению растворимости нитрата кальция. [13]
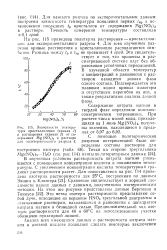 |
Зависимости температуры кристаллизации ( кривая 1 и растворения ( кривая 2 от содержания Mg ( NO3 2 в растворе для политермического разреза 4. [14] |
В изученных условиях растворимость нитрата магния уменьшается с повышением концентрации кислоты и понижением температуры. С увеличением концентрации кислоты температурный градиент растворимости растет. Сравнение свидетельствует о хорошей сходимости наших данных с данными, полученными изотермическим методом. Эти ветви изотерм растворимости представляют собой лучи, исходящие из вершины НМО3 треугольной диаграммы и отвечающие растворам, находящимся в равновесии с дигидратом нитрата магния и безводной солью. Предположительный ход изо-терм растворимости для 40 и 60 С на неисследованном участке обозначен пунктирной линией. [15]
Страницы: 1