Работа - ван-дро
Cтраница 1
Работа Ван-дер - Ваальса ясно показала, что для водорода эффект Джоуля - Томсона наблюдается только после того, как температура его снизится ниже некоторого определенного значения. И чтобы снизить температуру водорода до требуемого значения, перед проведением цикла расширения газ следует охладить. [1]
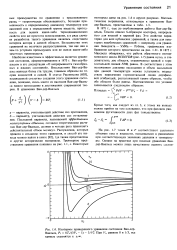 |
Изотермы приведенного уравнения состояния Ван-дер - Ваальса, Рг 8Tr / ( 3Vr - 1 - 3 / Уг - При Vr, равном 0 и 1 / 3, все кривые стремятся к оо. [2] |
В 1871 г., еще до опубликования работы Ван-дер - Ваальса, Томсон описал S-образную изотерму, непрерывную для жидкой и паровой фаз. Это свойство характерно для всех кубических уравнений, а также для некоторых некубических уравнений - например, для уравнения Бенедикта - Уэбба - Рубина, графическое изображение которого представлено на рис. 1.21. В 1875 г. Максвелл обнаружил, что работа обратимого изотермического цикла BCDEFDB ( рис. 1.7) равна нулю, а следовательно, две области, ограниченные кривой и горизонтальной линией FDB, равны. В соответствии с этим положением давление насыщения и объем насыщения при данной температуре можно установить посредством пересечения горизонтальной линии двухфазовой огибающей, расположенной таким образом, чтобы обе области были равны. [3]
Далее излагается термодинамический вывод законов Гиббса - Коновалова и Вревского, данный в работах Ван-дер - Ваальса и Сторонкина. [4]
Выражение ( 7) позволяет не только делать выводы относительно влияния параметров схемы контрольной аппаратуры на точность контроля, но и производить числовые расчеты. Однако в работе Ван-дер - Зила [18] не приведено методов расчета входящих в формулу ( 7) величин. Ниже излагается методика расчета их, предлагаемая автором. [5]
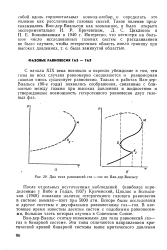 |
Два типа равновесий газ - газ по Ван-дер - Ваальсу. [6] |
С начала XIX века возникло и окрепло убеждение в том, что газы во всех случаях равномерно смешиваются и равномерная газовая смесь существует равновесно. Только в работах Ван-дер - Ваальса ( 90 - е годы) появились соображения, связанные с близостью между газами при высоких давлениях и жидкостями и утверждавшие возможность гетерогенного равновесия двух газовых фаз. [7]
Гипотеза о том, что агрегирующим фактором, вызывающим ожижение паров, являются силы притяжения, действующие внутри жидкости, впервые была высказана Юнгом и Лапласом. Она получила развитие главным образом на физической основе в работах Ван-дер - Ваальса и его школы и долго не пользовалась признанием со стороны химиков. Однако рост наших знаний в области строения атома и молекулы и развитие волновой механики приводят к все более ясному пониманию природы межмолекулярных сил и механизма их действия. Они являются, несомненно, результатом существования силовых полей вокруг поверхности молекулы, которые обусловлены наличием электронных структур атомов, входящих в ее состав. Хотя нормальная молекула всегда электрически нейтральна, ибо заключенные в ней положительные и отрицательные заряды равны по величине, но распределены эти заряды неравномерно. Отрицательные электроны мы представляем себе движущимися снаружи атома в ряде концентрических слоев, положительные же заряды концентрируются в ядре. Такая структура не может не отразиться на распределении силовых полей, существующих за пределами самой молекулы. Другими словами, несмотря на то, что молекула в целом электрически нейтральна, заряды на поверхности ее могут быть локализованы в разных точках. [8]
Подобие критических явлений в объектах разной природы позволяет рассматривать их с единой точки зрения. В 19 веке наиболее полно были исследованы переходы пар - жидкость и газ - жидкость. В работах Ван-дер - Ваальса, Клаузиуса, Дитеричи было получено приведенное уравнение состояния и сформулирован закон соответственных состояний [12] для приведенных величин. Приведенные значения получают делением количественных значений свойств на критические свойства. [9]
Полученные в этом исследовании результаты, а также данные Вибе и Гедди позволили установить ход критической кривой в этой системе. Критическая кривая, отходящая от критической точки аммиака, идет в сторону низких температур, затем проходит минимум и поворачивает в сторону высоких температур. Таким образом был впервые экспериментально обнаружен еще один вид критической кривой. Это и был случай, который в работах Ван-дер - Ваальса именовался вторым случаем равновесия газ - газ, а минимум на критической кривой был согласно его терминологии двойной гомогенной точкой. [10]
 |
Историческая справка о законах, описывающих поведение газов. [11] |
Еще на первоначальном этапе исследований было обнаружено, что закон идеальных газов зачастую может дать лишь очень приблизительное описание реального газа. Эти отклонения объяснялись тем, что молекулы имеют конечный объем, и влиянием межмолекулярных сил отталкивания и притяжения. Ван-дер - Ваальс ( 1873) предложил уравнение, в котором количественно учтены оба этих фактора, и впоследствии оно было положено в основу целого ряда уравнений состояния, широко применяемых в наши дни. Это уравнение количественно определяет условия одновременного существования жидкой и паровой фаз и критическое состояние системы. В этой же работе Ван-дер - Ваальс выдвинул очень важный принцип соответственных состояний ( см. разд. [12]
Страницы: 1