Радиус - атом - лантаноид
Cтраница 1
Радиусы атомов лантаноидов и их ионов средние между лантаном и скандием, поэтому свойства элементов семейства средние между ними. Наиболее характерной степенью окисления является 3, а у Cd и Zn это единственное состояние ионов. У церия, празеодима и тербия энергия двух электронов 4 / - подуровня сближена с энергией - подуровня. Гидрокеиды элементов обладают основными свойствами. Сила оснований и их растворимость падает от церия к лютецию. Вследствие близости энергетических характеристик 4 / - и 5d ] - электронов элементы легко переходят в возбужденное состояние. [1]
 |
Свойства лантаноидов. [2] |
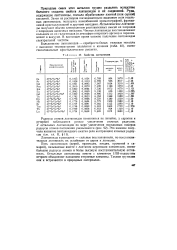
Радиусы атомов лантаноидов изменяются не линейно, у европия и иттербия наблюдается резкое увеличение атомных радиусов. [3]
Радиусы атомов лантаноидов были определены из кристаллических структур металлов. Большинство их имеет гексагональные решетки, европий имеет решетку объемноцентрированного куба, а иттербий - кубическую. Для церия, празеодима и неодима известно по две различные модисрикации. На рис. 12 показано изменение величин радиусов атомов ( сплошная линия) лантаноидов в зависимости от увеличения Z. Элементы, проявляющие валентность 2, характеризуются резким возрастанием радиусов их атомов ( у европия и иттербия), а для остальных вместе с ростом Z происходит уменьшение радиусов атомов, сжатие последних, называемое лантаноидным сжатием или контракцией. [4]
В связи с тем, что атомы актиноидов обладают 7 электронными уровнями и радиусы их больше радиусов атомов лантаноидов, содержащих лишь 6 электронных уровней, актиноиды должны обладать более сильными восстановительными свойствами, нежели лантаноиды. [5]
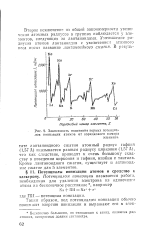 |
Зависимость изменения первых потенциалов ионизации атомов от порядкового номера. [6] |
Второе исключение из общей закономерности увеличения атомных радиусов в группах наблюдается у элементов, следующих за лантаноидами. Уменьшение радиусов атомов лантаноидов с увеличением атомного веса носит название лантаноидного сжатия. [7]
 |
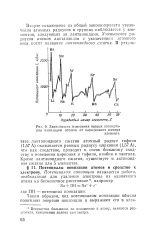
Зависимость радиусов атомов от порядкового номера элемента. [8] |
Второе исключение из общей закономерности увеличения атомных радиусов в группах наблюдается у элементов, следующих за лантаноидами. Уменьшение радиусов атомов лантаноидов с увеличением атомной массы носит название лантаноидного сжатия. Причина его та же самая - с увеличением заряда ядра растет притяжение электронов. В результате лантаноидного сжатия атомный радиус гафния ( 0 157 нм) оказывается равным радиусу циркония ( 0 157 нм), что, как следствие, приводит к очень большому сходству в химических свойствах циркония и гафния, а также ниобия и тантала. [9]
 |
Зависимость изменения первых потенциалов ионизации атомов от порядкового номера. [10] |
Второе исключение из общей закономерности увеличения атомных радиусов в группах наблюдается у элементов, следующих за лантаноидами. Уменьшение радиусов атомов лантаноидов с увеличением атомного веса носит название лантаноидного сжатия. [11]
Второе исключение из общей закономерности увеличения атомных радиусов в группах наблюдается у элементов, следующих за лантаноидами. Уменьшение радиусов атомов лантаноидов с увеличением атомной массы носит название лантаноидного сжатия. Причина его та же самая - с увеличением заряда ядра растет притяжение электронов. Число же электронных слоев в пределах одного и того же периода не увеличивается. В результате лантаноидного сжатия атомный радиус гафния ( 0 157 нм) оказывается равным радиусу циркония ( 0 157 нм), что, как следствие, приводит к очень большому сходству в поведении циркония и гафния, ниобия и тантала. Кроме лантаноидного сжатия, существует и актиноидное сжатие для 5 / - элементов. [12]
Интересная особенность обнаруживается у лантаноидов при сопоставлении радиусов атомов и ионов. В табл. 7.35 приведены радиусы атомов лантаноидов. [13]
С увеличением порядкового номера элемента от 58 до 71 радиусы атомов уменьшаются. Это обусловлено увеличением силы притяжения между ядром ( положительный заряд которого растет) и электронами. Уменьшение радиусов атомов лантаноидов с увеличением у них порядковых номеров называют лантаноидным сжатием. [14]
Неизменность радиуса у атомов элементов побочных подгрупп при переходе от пятого к шестому периоду объясняется так называемым лантаноидным сжатием. Суть этого явления заключается в следующем. Обычно в группе элементов сверху вниз в результате увеличения числа электронных слоев радиус атома должен увеличиваться, в периоде слева направо под влиянием увеличения заряда ядра - уменьшаться. В побочных подгруппах при переходе от четвертого к пятому периоду наблюдается некоторое увеличение радиусов атомов, но от пятого к шестому периоду радиусы не увеличиваются. Особенность шестого периода состоит в том, что он включает в себя 14 элементов-лантаноидов, стоящих между лантаном и гафнием, у которых заполняется третий сверху электронный слой. Увеличение заряда ядра на 14 единиц без изменения числа электронных слоев вызывает уменьшение радиусов атомов лантаноидов - лантаноидное сжатие. Следовательно, при переходе от лантана к гафнию радиус его атома уменьшается в большей степени, чем это наблюдается при переходе от III к IV группе у элементов побочных подгрупп четвертого и пятого периодов. Таким образом, несмотря на появление нового электронного слоя, радиусы атомов гафния и последующих за ним в периоде элементов оказываются примерно равными радиусам атомов выше расположенных в подгруппе элементов. [15]
Страницы: 1