Ионный радиус
Cтраница 2
Ионный радиус равен расстоянию от ядра до точки с минимальной электронной плотностью, лежащей на оси, которая соединяет ядра катиона и аниона. [16]
Ионные радиусы уменьшаются с ростом заряда иона ( табл. 11.6) и увеличиваются с возрастанием координационного числа. [17]
Ионные радиусы, соответствующие наиболее характерным зарядам этих ионов, указывают на расположение ветви / - переходных металлов ( самарий, тулий, плутоний) слева от ветви d - переходных металлов триад. В связи с тем, что железо, кобальт и никель в ионных кристаллах выступают в виде ионов с зарядами 2 и 3 -) -, а их тяжелые аналоги имеют ионы Ме4, все металлы VIII6 группы характеризуются близкими значениями ионных радиусов. [18]
Ионные радиусы, приведенные в табл. 18, соответствуют координационному числу 6, например КЧ ионов Na и С1 - в решетке хлорида натрия. В решетках, в которых ионы имеют различные координационные числа, их радиусы несколько отличаются друг от друга. [19]
Ионный радиус Н -, рассчитанный из приведенных выше значений, оказывается равным 1 54 А. [20]
Ионный радиус каждого из гидратированных ионов - около 3 5 А, и различия, обусловленные разными центральными ионами, почти исчезают, поэтому разность энергий между экспериментальными и теоретическими значениями практически постоянна для всех ионов. [21]
Ионные радиусы были предложены X. Ионные радиусы отличаются от атомных тем, что электроположительных элементов они меньше, чем соответствую-атомные радиусы, а для электроотрицательных элементов они больше атомных. [22]
Ионные радиусы, как и металлические радиусы, растут при переходе от лития к цезию. Однако количество молекул воды, удерживаемых ионом в гидратной оболочке, несмотря на увеличение размера иона, падает. Убедитесь в этом по табл. 7.7, где приведены так называемые числа гидратации, причем условно за единицу принято число молекул воды в гидратной оболочке цезия. [23]
Ионный радиус каждого из гидратированных ионов - около 3 5 А, и различия, обусловленные разными центральными ионами, почти исчезают, поэтому разность энергий между экспериментальными и теоретическими значениями практически постоянна для всех ионов. [24]
Ионный радиус Н -, рассчитанный из приведенных выше значений, оказывается равным 1 54 А. [25]
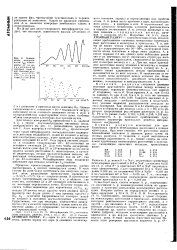 |
Зависимость интенсивности 12р компоненты 2Р от на-пряженности электрич. поля Е для времени пролета. 2 п512х XlO - с ( о и от ( при Е4 0 В / см ( б. [26] |
Ионные радиусы используют для приближенных оценок межъядерных расстоянил в ионных кристаллах. При этом считают, что расстояние между ближайшими катионом и анионом равно сумме их ионных радиусов. О точности, с к-рой выполняется указанная аддитивность А. [27]
Ионные радиусы, или, вернее, радиусы сфер действия, в структурах силикатов были вычислены В. [28]
Ионные радиусы используют для приближенных оценок кратчайших межъядерных расстояний в ионных кристаллах, предполагая, что эти расстояния равны сумме соответствующих ионных радиусов атомоа Существует неск. Впервые ионные радиусы были определены в 20 - х гг. 20 а В. М. Гольдшмидтом, опиравшимся на рефрактометрич. Полинга за основу принято значение радиуса иона О2, равное 0 140 нм, в распространенной системе Н. В. Белова и Г. Б. Бокия радиус этого же иона принят равным 0 136 нм, в системе К. [29]
Ионный радиус Y3 довольно близок к ионным радиусам редкоземельных элементов TR3, так что последние встраиваются в решетку ИАГ, замещая иттрий. Кроме того, имеется дополнительная возможность легирования ИАГ переходными металлами, которые легко встраиваются в решетку, замещая алюминий в узлах с октаэдрическим окружением. [30]
Страницы: 1 2 3 4