Кажущийся ионный радиус
Cтраница 1
Кажущийся ионный радиус возрастает с координационным числом. [1]
В табл. 4.20 приведены такие кажущиеся ионные радиусы. [2]
Значительные и не просто рассчитываемые изменения Кажущихся ионных радиусов могут быть вызваны поляризацией. [3]
Если сравнить эти радиусы с металлическими или ковалент-ными, а также с кажущимися ионными радиусами, определенными обычным методом, то видно, что они ближе всего к кажущимся ионным радиусам ( табл. 4 - 3), за исключением В г, для которого радиус, определенный по карте электронной плотности заряда для CuBr, ближе к значению, найденному для бромида металла группы IA. Нужно отметить и уменьшение значения для радиуса С1, определенного по карте для CuCl. Значительно меньшая ионность в соединениях Си1, конечно, не является неожиданной. Разумно принять, что степень близости радиуса, определенного по карте, с кажущимся ионным радиусом может служить своеобразной мерой ионного характера связи или ее ионности. Например, в последнем столбце табл. 4 - 3 приведены разности значений радиусов, определенных по карте, и ионных радиусов по Полингу. [4]
Если сравнить эти радиусы с металлическими или ковалент-ными, а также с кажущимися ионными радиусами, определенными обычным методом, то видно, что они ближе всего к кажущимся ионным радиусам ( табл. 4 - 3), за исключением В г, для которого радиус, определенный по карте электронной плотности заряда для CuBr, ближе к значению, найденному для бромида металла группы IA. Нужно отметить и уменьшение значения для радиуса С1, определенного по карте для CuCl. Значительно меньшая ионность в соединениях Си1, конечно, не является неожиданной. Разумно принять, что степень близости радиуса, определенного по карте, с кажущимся ионным радиусом может служить своеобразной мерой ионного характера связи или ее ионности. Например, в последнем столбце табл. 4 - 3 приведены разности значений радиусов, определенных по карте, и ионных радиусов по Полингу. [5]
Во-первых, ионные радиусы, приведенные для отдельных щелочных металлов, изменяются в разных соединениях этих элементов в меньшей степени, чем в соединениях элементов какой-либо другой группы периодической системы. Но даже и при этом различие между кажущимися ионными радиусами К и Na изменяется от 0 35 А во фторидах до 0 33 А в хлоридах, 0 32 А в бромидах и 0 30 А в иоди-дах. Второе обстоятельство относится к энтропиям гидратации. [6]
Благодаря этому отпадает необходимость в приготовлении растворов для калибрования. Константа диффузионного тока представляет также-и теоретический интерес, так как величина ее зависит при прочих равных условиях от величины коэффициента диффузии, а последняя - от кажущегося ионного радиуса. [7]
Если сравнить эти радиусы с металлическими или ковалент-ными, а также с кажущимися ионными радиусами, определенными обычным методом, то видно, что они ближе всего к кажущимся ионным радиусам ( табл. 4 - 3), за исключением В г, для которого радиус, определенный по карте электронной плотности заряда для CuBr, ближе к значению, найденному для бромида металла группы IA. Нужно отметить и уменьшение значения для радиуса С1, определенного по карте для CuCl. Значительно меньшая ионность в соединениях Си1, конечно, не является неожиданной. Разумно принять, что степень близости радиуса, определенного по карте, с кажущимся ионным радиусом может служить своеобразной мерой ионного характера связи или ее ионности. Например, в последнем столбце табл. 4 - 3 приведены разности значений радиусов, определенных по карте, и ионных радиусов по Полингу. [8]
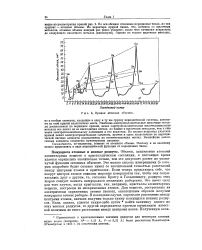 |
Кривая атомных объемов. [9] |
Объемы, занимаемые атомами элементарных веществ в кристаллическом состоянии, в настоящее время удается определить значительно точнее, чем это допускает расчет по упомянутой функции атомных объемов. Это можно сделать измерениями ( о которых подробнее будет сказано ниже) со значительной точностью расстояний между центрами атомов в кристаллах. Если теперь представить себе, что вокруг центров атомов описаны шаровые поверхности так, чтобы они соприкасались друг с другом, то, согласно Брэггу и Гольдшмидту, радиусы этих шаров следует назвать кажущимися атомными радиусами. Это имеет силу для того случая, когда кристаллы, как, например, кристаллы элементарных веществ, построены из незаряженных атомов. Для веществ, построенных из электрически заряженных атомов ( ионов), аналогичным образом получим кажущиеся ионные радиусы. В последнем случае, определяя расстояние между центрами атомов, сначала получим только сумму кажущихся ионных радиусов. Если, однако, удается каким-либо путем найти величину одного из этих ионных радиусов, то другой определяется простым вычитанием известной величины из всего расстояния между центрами ионов. [10]
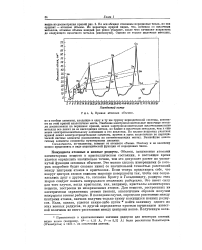 |
Кривая атомных объемов. [11] |
Объемы, занимаемые атомами элементарных веществ в кристаллическом состоянии, в настоящее время удается определить значительно точнее, чем это допускает расчет по упомянутой функции атомных объемов. Это можно сделать измерениями ( о которых подробнее будет сказано ниже) со значительной точностью расстояний между центрами атомов в кристаллах. Если теперь представить себе, что вокруг центров атомов описаны шаровые поверхности так, чтобы они соприкасались друг с другом, то, согласно Брэггу и Гольдшмидту, радиусы этих шаров следует назвать кажущимися атомными радиусами. Это имеет силу для того случая, когда кристаллы, как, например, кристаллы элементарных веществ, построены из незаряженных атомов. Для веществ, построенных из электрически заряженных атомов ( ионов), аналогичным образом получим кажущиеся ионные радиусы. В последнем случае, определяя расстояние между центрами атомов, сначала получим только сумму кажущихся ионных радиусов. Если, однако, удается каким-либо путем найти величину одного из этих ионных радиусов, то другой определяется простым вычитанием известной величины из всего расстояния между центрами ионов. [12]
Страницы: 1