Кажущийся радиус
Cтраница 4
При данных рабочем давлении, пластовом давлении, дебите, характеристике пласта и свойствах газа для вычисления радиуса, в пределах которого жидкость в пласте, по-видимому, течет по направлению к скважине, можно воспользоваться формулой установившегося радиального течения. Вся движущаяся по пласту жидкость высвобождается за счет изменения давления в пределах этого кажущегося радиуса дренирования. [46]
Расстояние между центрами ионов в кристалле можно поэтому приблизительно предсказывать, суммируя гольдшмидтовские кажущиеся радиусы соответствующих ионов. Большой точностью такого рода расчеты не обладают, так как в них не принимается вв внимание упомянутая выше зависимость кажущихся радиусов от координационного числа. Кроме того, при этом не учитывается также влияние на кажущийся радиус определенного иона специфических особенностей других ионов, с которыми он образует соединение. Например, радиус иона Na должен быть больше в том елучае, если он окружен одновалентными, а не двухвалентными отрицательными ионами. [47]
Расстояние между центрами ионов в кристалле можно поэтому приблизительно предсказывать, суммируя гольдшмидтовские кажущиеся радиусы соответствующих ионов. Большой точностью такого рода расчеты не обладают, так как в них не принимается во внимание упомянутая выше зависимость кажущихся радиусов от координационного числа. Кроме того, при этом не учитывается также влияние на кажущийся радиус определенного иона специфических особенностей других ионов, с которыми он образует соединение. Например, радиус иона Na должен быть больше в том случае, если он окружен одновалентными, а не двухвалентными отрицательными ионами. [48]
Высокую растворимость кислорода в металлах какого-либо ряда периодической системы следует ожидать только в определенном месте, а именно там, где отношение гм: го имеет наиболее подходящую величину. Точно указать, где она достигается, нельзя, так как это отношение зависит также от распределения электронов в металле, и поэтому кажущийся радиус иона кислорода зависит и от характера связи. Практически оказывается, что только Be, Ti, V, Zr, Hf и часть лантанидов могут растворять значительные количества кислорода. Хотя уже в хроме растворимость его значительно падает, она, по-видимому, гораздо больше, чем у других металлов. Значительную растворимость в металлах той же группы следует ожидать также у водорода и азота, тоже образующих маленькие ионы. Как известно, такая растворимость наблюдается. [49]
Функция распределения электронов в ионе не имеет определенной границы, поскольку плотность электронного распределения непрерывно убывает. Поэтому нельзя приписать иону какой-то характерный для него размер. Кажущийся радиус иона зависит от того, какое физическое свойство рассматривается, и будет различным для разных свойств. Нас интересуют такие ионные радиусы, чтобы сумма двух радиусов ( если необходимо, с некоторыми поправками) равнялась равновесному расстоянию между соответствующими соприкасающимися ионами в кристалле. Как будет показано ниже, равновесное расстояние между двумя ионами определяется не только характером распределения электронов в ионах, но также и структурой кристалла и отношением радиусов катиона и аниона. В качестве стандартных кристаллов мы выбираем кристаллы со структурой хлористого натрия, с отношением радиусов катиона и аниона равным около 0 75 и примерно с такой же степенью ионного характера связей, как в галогенидах щелочных металлов. [50]
Длина связи или расстояние между атомами определяется в первую очередь размерами атомов, соединенных связью. Для настоящей цели кажущийся радиус может быть принят для отдельного атома таким, чтобы сумма кажущихся радиусов атомов была равна длине связи. На длину связи в некоторой степени также влияет прочность связи: чем прочнее связь, тем короче длина. Поэтому кажущийся атомный радиус будет изменяться с типом связи; например, кажущийся атомный радиус углерода для одинарной ковалентной связи равен 0 77 А, для двойной связи он понижается до 0 67 А и для тройной связи до 0 60 А. [51]
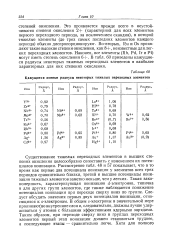 |
Кажущиеся ионные радиусы некоторых тяжелых переходных элементов. [52] |
Это проявляется прежде всего в неустойчивости степени окисления 2 ( характерной для всех элементов первого переходного периода, за исключением скандия), в которой тяжелые элементы ( до трех самых последних элементов каждого периода) обычно диспропорционируют. Во-вторых, Ru и Os проявляют такие высокие степени окисления, как 8, неизвестные для легких переходных элементов. В табл. 60 приведены кажущиеся радиусы некоторых тяжелых переходных элементов в наиболее характерных для них степенях окисления. [53]
Величина 2 08 А для радиуса свободного Н на первый взгляд оказывается непомерно большой, причем она более чем в два раза превышает радиус Не. Эти данные следуют из того, что заряд ядра Н - составляет только половину заряда ядра атома Не и что электроны взаимно отталкиваются и экранируют друг друга ( - на 30 /) от влияния ядер. Из табл. 6.2 видно, что кажущийся радиус Н - в щелочных гидридах не достигает величины 2 08 А, а также что он заметно уменьшается с уменьшением электроположительного характера металла. Небольшие в общем смысле размеры, вероятно, являются частично следствием легкой сжимаемости несколько диффузного иона Н -, частично - следствием определенной степени ковалентности связей. [54]
Страницы: 1 2 3 4