Развертывание - пептидная цепь
Cтраница 1
Развертывание пептидных цепей при денатурации подтверждается тем, что денатурированные белки дают более интенсивные цветные реакции, чем нативные белки. [1]
Этим путем мочевина может вызвать развертывание пептидных цепей и денатурацию белков. [2]
Устойчивость нативных белков к действию протеоли-тических ферментов связана, вероятно, с отсутствием в этих белках точек, на которые могли бы действовать молекулы фермента. При денатурации же белковой молекулы происходит развертывание пептидных цепей, в результате чего структуры, необходимые для действия фермента, становятся доступными и протеолиз может быть осуществлен. Такими группами для трипсина являются боковые цепи аргинина или лизина, имеющие щелочной характер ( см. стр. В нативных белках эти группы скрыты внутри глобулы и потому недоступны для действия фермента; небольшие же ионы водорода могут проникать к этим группам, вследствие чего они титруются кислотами. Появление этих групп на поверхности развернутых денатурированных молекул объясняет не только гидролиз этих молекул трипсином, но и возникновение межмолекулярных соле-образных связей и образование нерастворимых коагулятов ( см. стр. [3]
Известно, что некоторые электролиты повышают устойчивость белков. Повышение вязкости раствора также способствует снижению лабильности белков, так как при этом затрудняется развертывание пептидных цепей. Добавляемые в раствор белка нейтральные электролиты создают мостичные связи между белковыми молекулами, что также способствует повышению их устойчивости. [4]
Ферментативный характер процесса превращения фибриногена в фибрин в настоящее время не вызывает сомнения, однако сущность изменений, которые претерпевает при этом молекула фибриногена, остается до сих пор невыясненной. Есть основания полагать, что переход фибриногена в фибрин, подобно процессу денатурации нативного белка, заключается в развертывании пептидных цепей молекул фибриногена. Вполне возможно, однако, что гепарин влияет на первую фазу процесса свертывания, играя роль антипротромбина. [5]
Роль нуклеиновых кислот сводится, вероятно, к тому, чтобы удерживать белковую пленку шаблона в растянутом состоянии. В таком состоянии белковые пленки могут оставаться только под влиянием сил, действующих между поверхностями раздела. Эти силы вызывают развертывание пептидных цепей и удерживают их развернутыми в растянутой мономолекулярной пленке. Можно предположить, и это является весьма вероятным, что различные типы нуклеиновых кислот играют роль носителей белковых пленок шаблона и что замена одной нуклеиновой кислоты другой может до некоторой степени повлиять на образование копии. [6]
Изменение расположения пептидных цепей, превращение компактной молекулы в беспорядочный клубок, происходящее при денатурации, приводят к тому, что большинство пептидных связей становится доступным действию протеолитических фер-ментов. По-следняя особенность также является характерным признаком денатурации и свидетельством развертывания пептидных цепей. [7]
Развертывание пептидных цепей при денатурации подтверждается тем, что денатурированные белки дают более интенсивные цветные реакции, чем нативные белки. Таким образом, все приведенные данные подтверждают ту точку зрения, что при денатурации в связи с развертыванием пептидных цепей становятся доступными те активные группы, которые в нативных белках недоступны для соответствующих реактивов. [8]
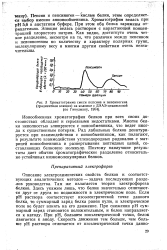 |
Хроматограмма смеси пепсина и пепсиногена. [9] |
Ионообменная хроматография белков при всех своих достоинствах обладает и серьезными недостатками. Многие белки неполностью элюируются с ионообменника, что ведет иногда к существенным потерям. Ряд лабильных белков денатурируется при взаимодействии с ионообменником, как полагают, в результате взаимодействия углеводородных радикалов с матрицей ионообменника и развертывания пептидных цепей, составляющих белковую молекулу. Поэтому наилучшие результаты дает обычно хроматографическое разделение относительно устойчивых низкомолекулярных белков. [10]
Денатурация часто сопровождается очень резкими изменениями в растворимости белков. Если удалить денатурирующий агент, то при рН раствора, близком к изоэлектрической точке белка, белок свертывается. Выше уже указывалось, что свертывание белков может быть обусловлено образованием межмолекулярных солевых мостиков между ионными группами, располагающимися на поверхности белковой молекулы при развертывании пептидных цепей. [11]
Связи, при помощи которых белок соединен с липидами в комплексе липопротеинов, принадлежат, вероятно, к различным типам. Эти комплексы, вероятно, образуются в организме в момент формирования макромолекулы белка. Можно представить себе, что липиды при этом проникают между свертывающимися пептидными цепями. Расщепление подобного комплекса может поэтому произойти только после развертывания пептидных цепей. [12]
Свертывание молока в желудке является одним из факторов, обусловливающих усвоение белков молока. Механизм свертывания остается еще неясным. Было высказано предположение, что нерастворимый сверток казеина представляет собой димер или полимер казеина или же комплекс казеина и фосфорнокислого кальция. Термины казеиноген ЕЛИ параказеин употребляются, однако, редко, так как ни об этих соединениях, ни об их роли в процессе свертывания молока ничего определенного сказать нельзя. Возможно, что фермент обусловливает некоторое развертывание пептидных цепей казеина, в результате чего полярные и ионные группы молекул казеина оказываются способными реагировать друг с другом с образованием межмолекулярных соле-образных связей. Этот процесс протекает только в присутствии ионов кальция. Способность молекул казеина к развертыванию цепей и образованию волокон была использована для приготовления из казеина искусственной шерсти. [13]
Страницы: 1