Разность - относительная электроотрицательность
Cтраница 1
Разность относительных электроотрицательностей составляет для Н - S 0 4, Н - N 0 9, Н - Ge 0 4, Н - К 1 3 ед. [1]
Разность относительных электроотрицательностей составляет для Н - S 0 4, H - - N 0 9, Н - Ge 0 4, Н - К 1 3 ед. Наибольшим процентом ионности обладает связь Н - К. [2]
 |
Полярная молекула с постоянным электрическим моментом диполя. [3] |
Чем больше разность относительных электроотрицательностей связанных атомов ( обозначим ее через Дх), тем сильнее выражена полярность. [4]
 |
Полярная моле кула с постоянным электрическим моментом диполя. [5] |
Чем больше разность относительных электроотрицательностей связанных атомов ( обозначим ее через Дя), тем сильнее выражена полярность. Предельная Ал; у CsF: 4 1 - 0 86 3 24, химическая связь между атомами ионная ( вплоть до Ах - 2), при Ал; 0 - неполярная ковалент-ная, в промежуточных случаях - полярная ковалентная. [6]
Чем больше по абсолютной величине разность относительных электроотрицательностей, тем более но-лярна связь. [7]
Чем больше по абсолютному значению разность относительных электроотрицательностей, тем более полярна связь. В данном примере наиболее полярной является связь сера - калий, наименее полярной - связь сера - углерод. [8]
 |
Сопоставление свойств связей Н-X в молекулах НС1, H2S и Н3Р. [9] |
Наблюдаемые закономерности также согласуются с предсказываемыми по разностям относительных электроотрицательностей. [10]
Как смещение электронной плотности в молекулах связано с разностью относительных электроотрицательностей атомов элементов, образовавших связь. [11]
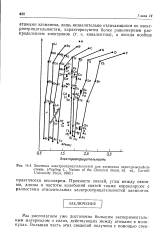 |
Значения электроотрицательиостей для элементов периодической системы. ( Pauling L, Nature of the Chemical Bond, 3d. ed., Cornell University Press, 1960. [12] |
Прочности связей, углы между связями, длины и частоты колебаний связей также коррелируют с разностями относительных электроотрицательностей элементов. [13]
Чем больше разность относительных электроотрицательностей атомов ( обозначим ее через А), тем сильнее выражена полярность. Предельная величина А у CsF; в этом соединении химическая связь между атомами ионная. При А0 связь будет неполярная ковалентная, в промежуточных случаях - полярная ковалентная. [14]
Страницы: 1