Разность - тепловой эффект
Cтраница 3
В табл. IV, 8 приведены тепловые эффекты двух пар однотипных реакций и отвечающие им значения ан. Для сравнения указаны также разности тепловых эффектов Ян - Постоянство обеих величин ая и Ян выдерживается хорошо. [31]
В тех же случаях, когда тепловые эффекты малы или противоположны по знаку или когда один из них в данном температурном интервале проходит через ноль ( меняя знак), отношение ДЯ и ЛЯ не остается постоянным. В этом случае обычно можно воспользоваться другим допущением о том, что разность тепловых эффектов не зависит от температуры. В табл. 24 сопоставлены ДЯ некоторых однотипных реакций при разных температурах. [32]
В тех же случаях, когда тепловые эффекты малы или противоположны по знаку или когда один из них в данном температурном интервале проходит через ноль ( меняя знак), отношение ДЯ и ЛЯ не остается постоянным. В этом случае обычно можно воспользоваться другим допущением о том, что разность тепловых эффектов не зависит от температуры. В табл. 24 сопоставлены ЛЯ некоторых однотипных реакций при разных температурах. [33]
 |
Соотношения между тепловыми эффектами ( в ккал / моль. [34] |
В тех же случаях, когда тепловые эффекты малы или противоположны по знаку или когда один из них в данном температурном интервале проходит через ноль ( меняя знак), отношение ДЯ и ДЯ не остается постоянным. В этом случае обычно можно воспользоваться другим допущением о том, что разность тепловых эффектов не зависит от температуры. В табл. 62 сопоставлены ДЯ некоторых однотипных реакций при разных температурах. [35]
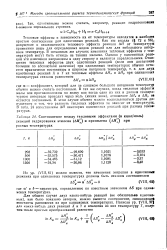 |
Соотношение между тепловыми эффектами ( в ккал / моль реакций гидрирования этилена ( Д и пропилена ( Д при разных температурах. [36] |
В тех же случаях, когда тепловые эффекты малы или противоположны по знаку или когда один из них в данной температурном интервале проходит через ноль ( меняя знак), отношение ДЯ и ДЯ, не остается постоянным. В этом случае обычно можно воспользоваться другим допущением о том, что разность тепловых эффектов не зависит от температуры, В табл, 24 сопоставлены ДЯ некоторых однотипных реакций при разных темпе ратурах. [37]
Большой интерес представляют методы сравнительного расчета термодинамических функций и различных свойств веществ, развитые в основном в советской литературе. В 1932 г. [22] была показана возможность характеристики химических свойств элементов по разности тепловых эффектов образования хлоридов и оксидов и расчета энергий решеток оксидов из энергий решеток хлоридов. [38]
Боем и Кофлин [98] измерили разницу энтальпий гексагонального и ромбоэдрического графитов. Предполагая, что эта разница будет невелика, они отказались от определения ее по разности тепловых эффектов при непосредственном сжигании образцов в кислороде. [39]
В табл. VI, 16 приведены тепловые эффекты этих реакций для ал т кенов от С2 до С6, разности К между ними и их отношения а. VII, 17 в сокращенной форме приведены аналогичные данные для изменения энтропии в этих реакциях. Только для сочетания низших гомологов С3 - С2 и С4 - С3 разность тепловых эффектов реакций довольно значительна и изменение ее с температурой для пары С4 - С3 достигает 1 ккал / моль. [40]
В обеих системах тепловые эффекты около 41 вычислены из данных, полученных при низшей температуре. В аммиачных растворах при повышении температуры эффект уменьшается, в то время как в растворах НС1 эффект увеличивается. Числа табл. 48 показывают, что найденные для растворов NH3 отрицательные температурные коэффициенты больше вычисленных. Так, для 20 % NH3 мы нашли Dg - 0.152, а Ц - 0.097. Разности тепловых эффектов, полученные из наблюдения, больше теоретических. [41]
Из соединений двухвалентного углерода с различными атомами лишь молекула СО не обладает химическими свойствами бирадикала. Таким образом, молекула СО занимает здесь такое же, но еще более ярко выраженное исключительное положение, как и молекула N0 среди монорадикалов. Это ясно из того факта, что при присоединении одного атома С1 к СО с образованием монорадикала СОС1 выделяется энергия, не превышающая нескольких больших калорий, в то время как нрп присоединении второго атома С1 с образованием фосгена выделяется около 80 ккал. Так как энергия обеих связей С - С1 и фосгене, очевидно, одинакова, то это означает, что разность тепловых эффектов присоединения первого и второго атомов Ci выражает собой ту энергию, которую нужно затратить на перевод СО в валентно-активное бирадикальное состояние. [42]
В обеих системах тепловые эффекты около 41 вычислены из данных, полученных при низшей температуре. В аммиачных растворах при повышении температуры эффект уменьшается, в то время как в растворах НС1 эффект увеличивается. Числа табл. 48 показывают, что найденные для растворов NH3 отрицательные температурные коэффициенты больше вычисленных. Так, для 20 % NH3 мы нашли Dg - 0.152, а Ц - 0.097. Разности тепловых эффектов, полученные из наблюдения, больше теоретических. В 20 % растворе НС1 Д 0.077, Д 0.124. Разности тепловых эффектов, полученные из наблюдения, меньше теоретических. [43]
Страницы: 1 2 3