Наблюдаемая разность - потенциал
Cтраница 1
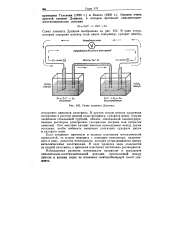 |
Схема элемента Даниэля. [1] |
Наблюдаемая разность потенциалов возникает в результате окислительно-восстановительной реакции, протекающей между цинком и ионами меди; ее называют электродвижущей силой элемента. [2]
Измерение электрического сопротивления электролитов затрудняется из-за поляризации электродов, которая приводит к тому, что наблюдаемая разность потенциалов металлических электродов оказывается больше, чем электродвижущая сила, которая в действительности вызывает ток. [3]
Однако если сравнить линии, наблюдавшиеся Лайманом в дальней, ультрафиолетовой области серии гелия, с линиями, возникающими при электронном ударе, то найдем, что наблюдаемые разности потенциалов точно соответствуют разнице энергий, рассчитанных по длинам волн. На нем указаны энергетические уровни, соответствующие напряжениям возбуждения и спектрам. Энергетические уровни обозначены на рисунке соответствующими квантовыми числами по теории Вора - Зоммерфельда. На рисунке не выдержан масштаб, так как иначе основной уровень пришлось бы расположить слишком далеко. [4]
В частности, в результате, исследований было установлено, что различные металлы, ооразуя гачьванопары, не вызывали появления должного количества коллоидных частиц, несмотря на наблюдаемую разность потенциалов, которая была неодинаковая у различных пар металлов. [5]
Если с обеих сторон мембраны ( см. рис. 61) помещены электроды, обратимые по отношению к одному из ионов, находящихся в растворе ( например, М, Х -), то в присутствии макроиона в камере II до тех пор, пока система находится в равновесии, наблюдаемая разность потенциалов будет равна нулю. Если, однако, мембрану убрать и заменить ее местом из насыщенного раствора КС1 ( причем теперь оба раствора находятся при атмосферном давлении), то система оставаться в равновесии уже не будет. [6]
Естественно, никакая разность потенциалов не может установиться между двумя электродами из одного металла, погруженными в растворы с одинаковыми концентрациями ионов этого металла; в этом случае АЕ всегда равно нулю. Наблюдаемая разность потенциалов АЕ позволяет оценить эту тенденцию; чем больше различие между концентрациями, тем сильнее тенденция. [7]
В случае гелия непосредственное спектральное наблюдение света, испускаемого при возбуждении за счет электронного удара, осложняется тем, что соответствующие линии лежат в дальней ультрафиолетовой области. Однако если сравнить линии, наблюдавшиеся Лайманом в дальней ультрафиолетовой области серии гелия, с линиями, возникающими при электронном ударе, то найдем, что наблюдаемые разности потенциалов точно соответствуют разнице энергий, рассчитанных по длинам волн. На нем указаны энергетические уровни, соответствующие напряжениям возбуждения и спектрам. Энергетические уровни обозначены на рисунке соответствующими квантовыми числами по теории Бора - Зоммерфельда. На рисунке не выдержан масштаб, так как иначе основной уровень пришлось бы расположить слишком далеко. [8]
В случае гелия непосредственное спектральное наблюдение света, испускаемого при возбуждении за счет электронного удара, осложняется тем, что соответствующие линии лежат в дальней ультрафиолетовой области. Однако если сравнить линии, наблюдавшиеся Лайманом в дальней ультрафиолетовой области серии гелия, с линиями, возникающими при электронном ударе, то найдем, что наблюдаемые разности потенциалов точно соответствуют разнице энергий, рассчитанных по длинам волн. На нем указаны энергетические уровни, соответствующие напряжениям возбуждения и спектрам. Энергетические уровни обозначены на рисунке соответствующими квантовыми числами по теории Бора - Зоммерфельда. [9]
В предшествующем обсуждении предполагалось, что падение напряжения между электродом сравнения и рабочим электродом равно нулю. В действительности это не соблюдается, так как раствор, через который проходит ток, обладает определенным сопротивлением. Таким образом, наблюдаемая разность потенциалов между электродом сравнения и рабочим электродом отличается от истинной на величину IR. Обычно кажущийся потенциал работающего электрода оказывается большим ( более положительным для окисления и более отрицательным для восстановления), чем истинный потенциал. Очевидно, и реакции протекают соответственно при более положительных или более отрицательных потенциалах, чем истинный. Результатом таких ошибок являются меньшие наклоны кривых ток - потенциал. Если наклоны используются для расчетов кинетических величин, то ошибка вносится и в эти расчеты. [10]
Окислительно-восстановительный потенциал обычно относится к нормальному водородному электроду, который определяется как имеющий нулевой потенциал. Как указывалось, если концентрация окисленной формы равна концентрации восстановленной формы, то член, выражающий отношение обеих форм, будет равен нулю и наблюдаемая разность потенциалов будет равна EQ. EQ называется стандартным окислительно-восстановительным потенциалом и применяется для сравнения окислительно-восстановительных систем друг с другом. [11]
Этот второй контакт представляет собой другой электрод со своим собственным ( характерным для него) потенциалом; при измерении определяют лишь алгебраическую разность между потенциалами. Поэтому удобно в качестве эталона условно выбрать какой-нибудь электрод, с которым можно было бы сравнивать другие. Он состоит из платиновой проволоки или фольги, покрытых платиновой чернью, над которой непрерывно пропускается ток водорода. Водород должен находиться под давлением в одну атмосферу, а раствор, в который он пропускается, должен содержать ионы водорода с активностью, равной единице. Потенциал этого стандартного электрода принимается равным нулю, а любому другому электроду, измеренному по отношению к водородному, приписывается потенциал, соответствующий наблюдаемой разности потенциалов. [12]
Страницы: 1