Алгебраическая разность - потенциал
Cтраница 1
Алгебраическая разность потенциалов между этими парами характеризует интенсивность процесса окисления - восстановления. [1]
ЭДС гальванического элемента представляет собой алгебраическую разность потенциалов обоих его электродов, в данном случае цинка и меди. [2]
Эта электродвижущая сила является алгебраической разностью потенциалов обоих электродов или полуэлементов, но так как потенциал одного из полуэлементов постоянен, то изменения непосредственно показывают величину изменения потенциала индикаторного электрода. Действительные значения потенциалов этого электрода определять незачем, так как для титрования имеют значение лишь относительные величины изменения потенциала. [3]
Два электрода, погруженные в соответствующие растворы, образуют гальванический элемент, напряжение которого равно алгебраической разности потенциалов этих электродов. [4]
Если бы выделение водорода и хлора при электролизе хлористых солей протекало на электродах обратимо, то алгебраическая разность потенциалов электродов дала бы значение теоретически необходимого напряжения разложения хлористых солей. [5]
При составлении гальванического элемента из каких-либо электродов можно заранее определить его свойства, пользуясь рядом напряжений, так как из двух металлов, при равной концентрации ионов, металл, стоящий выше в ряду напряжений, образует всегда отрицательный полюс, а стоящий ниже - положительный, причем электродвижущая сила такого элемента будет равна алгебраической разности потенциалов первого и второго металлов. [6]
Алгебраическая разность потенциалов для выделения анионов и для выделения катионов является тем напряжением, ниже-которого электролиз не может пойти. [7]
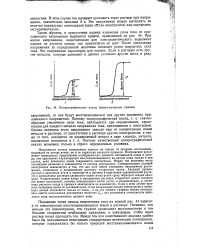 |
Полярографические волны ( вольт-амперные кривые. [8] |
Напряжение начала электролиза зависит не только от природы восстанавливающихся на катоде ионов, но и от характера анодного процесса. Напряжение разложения электролита представляет алгебраическую разность потенциалов анода и катода; оно однозначно характеризует восстанавливающиеся на катоде ионы только в том случае, если потенциал анода сохраняется неизменным. Между тем величина этого потенциала различна в зависимости от состава электролита. Стандартизация условий электролиза заключается в том, что для всех ионов указывают напряжение разложения, отнесенное к насыщенному раствору хлористого калия. Анодный процесс состоит в окислении ртути и переходе ее в раствор в виде ионов одновалентной ртути. Но в насыщенном растворе хлористого калия ионы ртути сразу образуют осадок каломели. Концентрация ионов хлора в насыщенном растворе хлористого калия остается все время постоянной, поэтому концентрация ионов ртути, а следовательно, и потенциал ртутного анода в процессе электролиза не изменяются. Если в этом случае принять потенциал анода за условный нуль, тогда напряжение начала электролиза и потенциал катода отличаются только по знаку, и на осп абсцисс графика можно откладывать вместо напряжения разложения величину Et. [9]
Электродвижущая сила элемента равна алгебраической разности скачков потенциалов, которые существуют на границе электрод - раствор. Поэтому потенциал разложения электролита равняется алгебраической разности потенциалов, которая необходима для выделения аниона и катиона при условии отсутствия поляризации электродов и перенапряжения. [10]
При электролизе приходится учитывать напряжение разложения, выход по току и по энергии. Теоретически наименьшее напряжение, необходимое для проведения электролиза ( напряжение разложения), равно алгебраической разности потенциалов разряда катиона и разряда аниона. [11]
При электролизе приходится учитывать напряжение разложения, выход по току и по энергии, а также стоимость исходных веществ, затраты на устройство электролизеров и их обслуживание. Теоретически наименьшее напряжение, необходимое для проведения электролиза ( напряжение разложения), равно алгебраической разности потенциалов разряда катиона и разряда аниона. [12]
Окислительно-восстановительные потенциалы позволяют количественно судить об активности окислителя и восстановителя и, следовательно, о направлении окислительно-восстановительной реакции. В ряду окислительно-восстановительных пар каждая пара, характеризующаяся большей алгебраической величиной потенциала, будет играть роль окислителя по отношению к паре, имеющей меньшую алгебраическую величину потенциала, а алгебраическая разность потенциалов между отдельными парами характеризует интенсивность процесса. [13]
Окислительно-восстановительные потенциалы позволяют количественно судить об активности окислителя и восстановителя и, следовательно, о направлении окислительно-восстановительной реакции. В ряду окислительно-восстановительных пар, каждая пара, характеризующаяся большей алгебраической величиной потенциала, будет играть роль окислителя по отношению к паре, имеющей меньшую алгебраическую величину потенциала, а алгебраическая разность потенциалов между отдельными парами характеризует интенсивность процесса. [14]
Каждая пара с большим потенциалом может быть окислителем для пары с меньшим потенциалом. Алгебраическая разность потенциалов между этими парами характеризует процесс окисления - восстановления. [15]
Страницы: 1 2