Разрушение - кристаллическая решетка - вещество
Cтраница 1
Разрушение кристаллической решетки вещества и диссоциация молекул на ионы. [1]
Для разрушения кристаллической решетки вещества необходимо затратить большую энергию. [2]
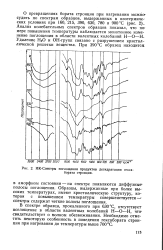 |
ИК-Спектры поглощения продуктов дегидратации гекса-бората стронция. [3] |
О превращениях бората стронция при нагревании можно судить по спектрам образцов, выдержанных в изотермических условиях при 160, 215, 390, 630, 780 и 900 С ( рис. 2), Анализ колебательных спектров образцов показал, что по-мере повышения температуры наблюдается монотонное изменение поглощения в области валентных колебаний Н - О - Н Удаление Н2О и ОН-групп связано с разрушением кристаллической решетки вещества. [4]
Растворение твердых веществ в воде сопровождается поглощением или выделением тепла. Разрушение кристаллической решетки вещества связано с затратой энергии, а поэтому растворение твердых веществ в жидкостях большей частью сопровождается поглощением тепла. Одновременно с разрушением кристаллической решетки идет сольватация ( соединение) растворяемых частиц с молекулами растворителя, при этом выделяется энергия. [5]
Технический хлористый аммоний NH4C1 ( ГОСТ 2210 - 51), или нашатырь, представляет собой белое кристаллическое вещество с удельным весом 1 54 г / см3, при нагревании, не плавясь, разлагается. При 20 С в 100 г воды растворяется 37 5 г нашатыря, а при 100 С-773 г. При растворении хлористого аммония в воде происходит значительное охлаждение раствора из-за затраты тепла при разрушении кристаллической решетки вещества. [6]
Технический хлористый аммоний NH4C1 ( ГОСТ 2210 - 73), или нашатырь, представляет собой белое кристаллическое вещество плотностью 1540 кг / м3, при нагревании, не плавясь, разлагается. При 20 С в 100 г воды растворяется 37 5 г нашатыря, а при 100 С - 77 3 г. При растворении хлористого аммония в воде происходит значительное охлаждение раствора из-за затраты тепла при разрушении кристаллической решетки вещества. [7]
Процессы переноса энергии в твердых телах происходят сложнее, чем в жидкостях. В твердом веществе радиус упорядоченного взаимодействия молекул значительно больше, чем в жидкой среде. Затрата энергии идет не только на десорбцию отдельных молекул, но и на разрушение кристаллических решеток вещества и на вырывание комплексов с твердой поверхности. [8]
Процессы переноса энергии в твердых телах протекают еще сложнее, чем в жидкостях. В частности, это относится к процессу сублимации - испарения с твердой поверхности. Радиус упорядоченного взаимодействия молекул твердого вещества значительно больше, чем жидкого. Энергия затрачивается не только на десорбцию отдельных молекул, но и на разрушение кристаллических решеток вещества и на вырывание комплексов с твердой поверхности. [9]
Процессы переноса энергии в твердых телах происходят еще сложнее, чем в жидкостях. В частности это относится к процессу сублимации - испарения с твердой поверхности. В твердом веществе радиус упорядоченного взаимодействия молекул значительно больше, чем в жидкой среде. Затрата энергии идет не только на десорбцию отдельных молекул, но и на разрушение кристаллических решеток вещества и на вырывание комплексов с твердой поверхности. [10]
Взаимодействуя с ионами, молекулы растворителя образуют сольватные оболочки. Внутренняя, или первичная, оболочка включает молекулы, перемещающиеся совместно с ионом. Количество таких молекул определяет число сольватации ( гидратации) иона. Электростатическое взаимодействие первично сольватиро-ванного иона с молекулами растворителя приводит к появлению внешней, или вторичной, оболочки. Образующие ее молекулы отличаются по состоянию от молекул чистого растворителя, но в перемещениях иона могут не принимать участия. Сольватация возникает не только за счет электростатического взаимодействия, но и за счет химических сил. Энергия взаимодействия между ионами и растворителем, называемая энергией сольватации, вызывает разрыв-связей-в молекулах или разрушение кристаллической решетки вещества. [11]
Взаимодействуя с ионами, молекулы растворителя образуют сольватные оболочки. Внутренняя, или первичная, оболочка включает молекулы, перемещающиеся совместно с ионом. Количество таких молекул определяет число сольватации ( гидратации) иона. Электростатическое взаимодействие первично сольватиро-ванного иона с молекулами растворителя приводит к появлению внешней, или вторичной, оболочки. Образующие ее молекулы отличаются по состоянию от молекул чистого растворителя, но в перемещениях иона могут не принимать участия. Сольватация возникает не только за счет электростатического взаимодействия, но и за счет химических сил. Энергия взаимодействия между ионами и растворителем, называемая энергией сольватации, вызывает разрыв связей в молекулах или разрушение кристаллической решетки вещества. [12]
Страницы: 1