Разряд - аккумулятор
Cтраница 3
При разряде аккумулятора ( рис. 264) положительные ионы Н2 и отрицательные ионы кислотного остатка SO4, на которые распадаются молекулы серной кислоты H2SO4 электролита, направляются соответственно к положительному и отрицательному электродам и вступают в электрохимические реакции с их активными массами. При этом запасенная в аккумуляторе химическая энергия переходит в электрическую и между его электродами возникает разность потенциалов около 2 в, обеспечивающая прохождение электрического тока при замыкании внешней цепи. [31]
При разряде аккумуляторов процессы идут слева направо, при заряде - наоборот. [32]
 |
Показатели некоторых серебряно-цинковых аккумуляторов. [33] |
При разряде аккумуляторов так - же наблюдаются две площадки, но при повышенных плотностях тока площадка, соответствующая более высокому напряжению, так мала, что практически весь разряд протекает при одном напряжении. [34]
При разряде аккумулятора окись серебра переходит в металлическое серебро, а металлический цинк - в окись цинка. [35]
При разряде аккумулятора имеет место обратная картина. Поверхностные участки пор положительного электрода по мере разряда постепенно обедняются высшим окислом ввиду замедленности диффузии ионов кислорода из внутренних зон электрода, в результате чего реакционная поверхность пор постепенно приближается по составу к переходному слою. В соответствии с этим растет сопротивление электрода, которое достигает максимального значения при сформировании переходного барьера. При продолжении разряда вследствие полного истощения в поверхностном слое высшего окисла серебра внутреннее сопротивление электрода падает до значения, характерного для протекания второго катодного процесса. [36]
При разряде аккумулятора процессы протекают в обратном направлении. В момент восстановления всей поверхности гокоотвода до Ag2O сопротивление электрода достигает максимальной величины. При продолжении разряда сопротивление падает из-за диффузии оставшейся AgO к реакционной поверхности. [37]
При разряде аккумулятора на положительных и отрицательных пластинах образуется сульфат свинца, что является естественным результатом процесса разряда. Такой сульфат при заряде аккумулятора без всяких затруднений превращается в активные вещества. [38]
При разряде аккумуляторов накопленная электрическая энергия расходуется во внешней цепи нагрузки, подключенной к аккумуляторам. В зависимости от назначения аккумуляторы и собранные из них батареи разделяют: на стационарные - для электропитания аппаратуры связи, электрических станций и подстанций и пр. [39]
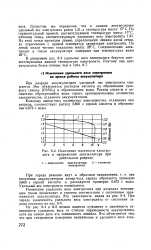 |
Изменение плотности электролита и напряжения аккумулятора при длительном разряде. [40] |
При разряде аккумуляторов удельный вес электролита снижается. Это объясняется расходом кислоты на образование сульфата свинца ( PbSO4) и образованием воды. Расход кислоты и количество образующейся воды строго пропорциональны количеству электричества, отданного аккумулятором. [41]
При разряде аккумуляторов нужно соблюдать следующие правила. Максимальный разрядный ток не должен превышать Vio емкости аккумулятора. Надо остерегаться короткого замыкания аккумулятора, которое еще более опасно, чем у гальванических элементов. При коротком замыкании возникает очень большой ток, вызывающий порчу аккумулятора: его пластины коробятся и из них выпадает активная масса, которая может замкнуть накоротко пластины. Ясно, что нельзя пробовать аккумулятор на искру, соединяя его полюсы нако ротко. [42]
При разряде аккумуляторов происходит процесс взаимодействия активных масс с серной кислотой. Вследствие этого потенциал положительной пластины становится более отрицательным, а потенциал отрицательной пластины более положительным. Для практических целей наиболее удобным является кадмиевый электрод. [43]
При разряде аккумуляторов допускают различные плотности тока в зависимости от типа и конструкции аккумулятора. Плотностью тока называют число ампер, приходящихся на единицу поверхности пластин. [44]
При разряде аккумулятора малыми плотностями тока на кривой зависимости напряжения от времени разряда также получаются две площадки. [45]
Страницы: 1 2 3 4 5