Практическая величина
Cтраница 1
Практические величины выхода NaHCO3 всегда меньше теоретических, прежде всего по той причине, что составы кар-бонизованных растворов, отвечающие точке Р ( табл. Г4, рис. 98 - 6), в производственных условиях недостижимы. [1]
Практическая величина пробы для насадочных колонок с внутренним диаметром 5 мм равна для жидкости 1 - 10 мкл, для веществ, вводимых в виде разбавленных растворов, более 10 мкл, а для газа - 1 - 10 мл. Величина пробы устанавливается в зависимости от количества жидкой фазы в колонке или пропорционально площади поперечного сечения колонки, отвечающей данному процентному содержанию жидкой фазы в насадке. В тех случаях, когда разделение не встречает затруднений, допустимы значительно более крупные пробы, тогда как в трудных. [2]
Практическая величина пробы для насадочных колонок с внутренним диаметром 5 мм равна для жидкости 1 - 10 мкл, для веществ, вводимых в виде разбавленных растворов, более 10 мкл, а для газа - 1 - 10 мл. Величина пробы устанавливается в зависимости от количества жидкой фазы в колонке или пропорционально площади поперечного сечения колонки, отвечающей данному процентному содержанию жидкой фазы в насадке. В тех случаях, когда разделение не встречает затруднений, допустимы значительно более крупные пробы, тогда как в трудных случаях разделения следует применять маленькие пробы, дающие более симметричные пики и лучшее разделение. [3]
Практическая величина TS равна примерно 2 сек. [4]
Практические величины параметров определяются характеристиками исследуемой химической системы. Обычно величина тока лежит в пределах от 0 1 до 10 а. Величина выходного напряжения при этих токах определяется внутренним сопротивлением ячейки. При определении концентрации электроактивных веществ важнее получить большой выходной ток, так как при малых токах увеличивается продолжительность электролиза. При большом выходном токе время реакции составляет примерно несколько секунд. Для большинства аналитических работ диапазон потенциостатирования обычно находится в пределах от 2 5 до - 2 5 в и точность поддержания потенциала 10 мв. [5]
Практические величины коэффициентов утилизации всегда меньше теоретических прежде всего по той причине, что составы карбонизованных растворов, отвечающих точке Р, в производственных условиях недостижимы. Поэтому производстве степень иснильаивамия натрия обычно составляет 65 - 75 %, а степень использования аммиака-68 - 72 %, в зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов. [6]
Практические величины коэффициентов утилизации всегда меньше теоретических прежде всего по той причине, что составы карбонизованных растворов, отвечающих точке Р, в производственных условиях недостижимы. [7]
Практической величиной, характеризующей электростатическое поле аниона, может служить его подвижность, поскольку она в некоторой мере учитывает все упомянутые выше факторы. [8]
Определение практической величины растворимости 1 10-фенантролина в хлороформе показало, что насыщенный при комнатной температуре раствор получается при растворении 47 - 48 г безводного 1 10-фенантролина в 100 мл хлороформа или 80 г двойного соединения 1 10-фенантролина с хлороформом в 80 мл хлороформа. Таким образом, практическая растворимость 1 10-фенантролина в хлороформе при комнатной температуре равна 1 г в 2 мл. [9]
Инструментальное определение практической величины рН [ уравнение (11.26) ] свидетельствует о том, что эта величина не является точной мерой ни концентрации, ни активности ионов водорода. Цель установления рН - стандартов двояка: во-первых, обеспечить общую основу для всех измерений рН, имея в виду, что численные величины рН будут воспроизводимы во времени и на разных установках, и, во-вторых, путем установления соответствующих стандартных значений рН придать измеренным рН возможно больше количественного смысла с точки зрения химического равновесия. [10]
Инструментальное определение практической величины рН [ уравнение (11.26) ] свидетельствует о том, что эта величина не является точной мерой ни концентрации, ни активности ионов водорода. Цель установления рН - стандартов двояка: во-первых, обеспечить общую основу для всех измерений рН, имея в виду, что численные величины рН будут воспроизводимы во времени и на разных установках, и, во-вторых, путем установления соответствующих стандартных значений рН придать измеренным рН возможно больше количественного смысла с точки зрения химического равновесия. [11]
Для перехода к практическим величинам полученные значения при расчете по методу Джиллилэнда увеличивают примерно в 3 - 4 раза. [12]
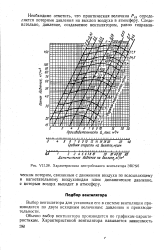 |
Характеристика центробежного вентилятора 3BPN6. [13] |
Необходимо отметить, что практическая величина Рд2 определяется потерями давления на выхлоп воздуха в атмосферу. [14]
В табл. 13 и 14 приведены практические величины обжатия. [15]
Страницы: 1 2 3 4