Распад - комплексный ион
Cтраница 1
Распад комплексных ионов носит ступенчатый характер, аналогично диссоциации многоосновных кислот. Сначала отщепляется один адденд, затем другой и так далее. [1]
Процесс распада комплексных ионов в растворе протекает многоступенчато, с последовательным отщеплением лигандов. [2]
В более общем случае многоступенчатого распада комплексного иона описанный выше прием позволяет проверить гипотезу о составе промежуточных комплексных частиц в растворе и установить области их существования. [3]
Комплексные соединения при электролизе могут разрушаться; апример при электролизе аммиачного раствора никеля происходит распад комплексного иона Ni ( NH3) 4 с выделением на катоде металлического никеля. [4]
При повышении температуры отрицательные значения энергии Гиббса и энтальпии уменьшаются, что связано с частичным распадом комплексных ионов на более простые. [5]
Он отметил, что не удивительно, если Габер, исходя из нереальных предпосылок, пришел к нереальным скоростям образования и распада комплексных ионов. [6]
Их сопоставление прежде всего показывает, что широко распространенное ранее деление солей на двойные и комплексные является весьма условным и зависящим от чувствительности реактива, применяемого для обнаружения распада комплексного иона. [7]
С повышением температуры оно смещается вправо, что легко заметить по изменению окраски раствора. Поскольку процесс распада комплексных ионов обратим, то понижение концентрации одного из компонентов, входящих в состав комплексного иона, может вызвать его разрушение. Это происходит в том случае, если в раствор введено вещество, с которым лиганды или комплексообразователь связываются более прочно, чем они были связаны в комплексе. [8]
Разбавление раствора увеличивает, по мнению авторов исследования [164], не столько степень электролитической диссоциации SbF3, сколько ее гидролиз. Это явление может быть связано и с прогрессирующим распадом комплексных ионов. [9]
Для определения констант комплексообразования и коэффициентов распределения был применен ионообменный метод. Особенно существенным с точки зрения хроматографии является знание величины константы равновесия распада комплексного иона под действием ионов водорода. [10]
Такого рода комплексные гидриды обладают свойствами солей. Многие комплексные гидриды растворяются в воде и неводных растворителях, при этом возможна ионизация без распада комплексного иона. Водные растворы боргидридов натрия и калия сравнительно устойчивы. [11]
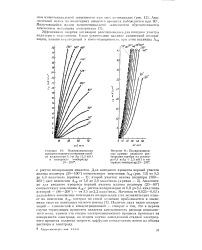 |
Поляризационные кривые анодного растворения серебра из раствора 0 1 niAg 2 5 mKl в интервале температур 20 - 200. [12] |
Аналогично для анодного процесса первый участок излома политерм ( 20 - 80) соответствует изменению Азф с ростом поляризации от 6 8 до 3 5 ккал / моль и второй - ( 80 - 200) - от 3 5 до 2 2 ккал / моль. Наличие двух видов поляризаций - химической и концентрационной - говорит о том, что в первом случае тормозящим процессом является замедленность распада комплексного иона, причем эта стадия электрохимического процесса протекает на поверхности электрода; во втором случае замедленной стадией электродного процесса является скорость диффузии комплексных ионов из объема раствора к электроду. [13]
Чаще деполяризации подвергается менее благородный металл, что объясняется его вхождением в решетку более благородного металла, а также возникновением химического соединения. Изменение поляризации металлов при их соосаждении обусловлено изменениями потенциала нулевого заряда; строения двойного электрохимического слоя, концентрации разряжающихся ионов в нем; энергии активации, дегидратации и распада комплексных ионов. [14]
Некоторые соли занимают промежуточное положение между комплексными и двойными солями. Такие соли характеризуются сравнительно большой величиной К распада, но все же в их растворах равновесные концентрации комплексных ионов преобладают над равновесными концентрациями частиц, образующихся в результате распада комплексных ионов. Как было указано выше, комплексный ион [ Ag ( N02) 2 ] - характеризуется достаточно большой величиной константы нестойкости. В дальнейшем будет подсчитан ( пример 3, стр. [15]
Страницы: 1 2