Распад - окись - углерод
Cтраница 1
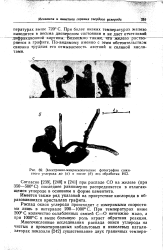 |
Электронно-микроскопические фотографии сажистого углерода до ( а и после ( б его обработки НС1. [1] |
Распад окиси углерода происходит с измеримыми скоростями лишь в интервале 200 - 1000 С. При температурах ниже 200 С количество ослабленных связей С-О ничтожно мало, а при 1000 С и выше большую роль играет обратная реакция. [2]
Реакция распада окиси углерода ( V-12) в интервале температур 500 - 600 К идет с большой глубиной превращения и, по-видимому, имеет место в действительности, когда процесс термического разложения пентакар-бонила железа проводится в отсутствие аммиака. В этом случае реакция ( V-12) обусловливает наличие в порошковом карбонильном железе элементарного углерода, а в газе разложения наряду с реакцией ( V-9) - примеси углекислоты. [3]
Описанная схема распада окиси углерода возможна, однако, лишь в начальный период действия катализатора. Как отмечалось ранее, рентгенографические исследования, а также элементарные расчеты количества выделяющегося сажистого углерода показывают, что последний образует кристаллы, достигающие иногда тысячи атомных размеров. [4]
В ряде работ установлено, что реакция распада окиси углерода развивается на поверхности твердых катализаторов. Многие твердые тела, адсорбируя молекулы СО, сильно их деформируют, уменьшают связь атомов углерода с кислородом и этим способствуют течению реакции. К их числу принадлежат железо, никель, кобальт, возможно - марганец, алюминий, уран и титан, а совершенно интертными являются, например, серебро, медь, кремний, паладий, родий, молибден и вольфрам. [5]
Иногда полагают, что не железо, а его карбиды ускоряют распад окиси углерода. [6]
Есин и Гельд [4] для объяснения непрекращающегося каталитического воздействия кристаллов на распад окиси углерода после обильного отложения сажи выдвинули схему механизма, согласно которой адсорбцию и расщепление молекул СО ведут в этих условиях микрокристаллические образования сажи. Отщепляющийся кислород мигрирует через решетку графита на обнаженные участки железной поверхности, откуда снимается молекулами СО, атакующими эти участки из газовой фазы. [7]
Руденко и С. Т. Ростовцеву [243] при восстановлении окиси железа добавка Нз и СО также ускоряет ( при 600 С) распад окиси углерода. Однако, в этих условиях наибольшее количество элементарного углерода появляется при работе со смесью, содержащей 10 % Нз и 90 % СО. [8]
В измерениях Н. Ф. Юшкевича обращает на себя внимание то обстоятельство, что равновесное процентное содержание СО, полученное в результате распада окиси углерода, обычно больше, чем найденное при взаимодействии ССЬ с С. Едва ли это можно объяснить тем, что полное равновесие в системе в обоих случаях не было достигнуто. [9]
В процессе кислородной конверсии углеводородных газов продукты реакции по пути в скруббер проходят по каналу, выложенному шамотом, катализирующим распад окиси углерода. [10]
Вследствие того что реакция образования окиси углерода сопровождается увеличением числа молекул газообразной фазы, повышение давления смещает равновесие в сторону распада окиси углерода на С и СО2, а уменьшение давления способствует образованию окиси углерода. [11]
Гибер [189], изучавшие влияние окислов железа, никеля, кобальта, алюминия, марганца, хрома, цинка и меди, обосновывают свой вывод о металлической природе катализатора лишь на основании существования максимума скорости распада окиси углерода на окислах. [12]
Наряду с большим сходством молекул N2 и СО, подтверждением указанного механизма может служить также и то обстоятельство, что железо ( в особенности промотировашюе окислами калия и алюминия [195]) является катализатором не только распада окиси углерода и синтеза аммиака; оно ускоряет и горение водорода. Температуры инактивации железа как катализатора для всех трех этих реакций очень близкя между собой, что указывает на участие одинаковых центров поверхности в ускорении этих процессов. [13]
Превращение окиси углерода в углекислый газ сопровождается отложением кристаллов графита на железном катализаторе. Распад окиси углерода продолжается и после покрытия катализатора слоем углерода. [14]
В силу этого протекание реакции с заметной скоростью становится возможным лишь в присутствии катализаторов, которыми служат поверхности ряда твердых тел. Поэтому реакция распада окиси углерода является в кинетическом отношении гетерогенной и осуществляется не в объеме газа, а на поверхности катализатора. Начальным этапом ее, подобно процессам горения угля, является хемадсорбция молекул СО, в результате которой связи атомов С и О под воздействием силового поля поверхностных атомов катализатора значительно ослабляются. [15]
Страницы: 1 2 3