Распад - свободный радикал
Cтраница 2
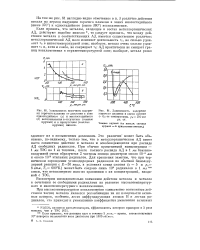
Это различие может быть объяснено, по-видимому, только тем, что в металлорганическом АД имеет место совместное действие и металла и освобождающихся при распаде АД свободных радикалов. При обычно применяемой концентрации - 1 мл ТЭС на 1 кг топлива, после полного распада АД в 1 мл бензино-воздушной смеси образуются 2 частицы свинца диаметром около 10 5 мм и около 1015 этильных радикалов. Для сравнения заметим, что при термическом зарождении углеводородных радикалов по обычной бимолекулярной реакции с Е50 ккал, в условиях конца сжатия ( е 5 и рс 8 атм, Тс - 600 К) может быть создано лишь 108 радикалов в 1 мл смеси, что несоизмеримо мало по сравнению с их концентрацией, вводимой с ТЭС. [17]
Это различие; может быть объяснено, по-видимому, только тем, что в металлорганическом АД имеет место совместное действие и металла и освобождающихся при распаде АД свободных радикалов. При обычно применяемой концентрации - 1 мл ТЭС на 1 кг топлива, после полного распада АД в 1 мл бензино-воздушной смеси образуются 2 частицы свинца диаметром около 10 - 5 мм и около 1015 этильных радикалов. Тс 600 К) может быть создано лишь 108 радикалов в 1 мл смеси, что несоизмеримо мало но сравнению с их концентрацией вводимой с ТЭС. [19]
Аналогично протекает крекинг высокомолекулярных парафинов. Только нухно иметь з виду, что распад свободных радикалов идет по Jb - правилу. Это приводит К обрааованип преимущественно этилене при глубоком крекинге. [20]
В этом случае, как видим, помимо углеводородного и гидроксильного радикалов, образуется молекула альдегида. Действительно, такое действие гидроперекиси тетралина может быть объяснено образованием при ее распаде свободных радикалов. [21]
Прочность связи С-С в парафиновых углеводородах составляет приблизительно 80 ккал / моль, и при температурах ниже 400 углеводороды не распадаются по свааи С-С. Введение в молекулу углеводорода фенильных групп приводит к ослаблению связи С - С вследствие стабилизации образующихся при распаде свободных радикалов. [22]
Значение константы, полученное Фаркасом и Пассалья, в 70 раз меньше, чем при распаде в среде окисляющего углеводорода. Такое различие в скоростях распада гидроперекиси циклогексила может быть следствием ряда причин: различия материала стенок сосуда, ускоряющего влияние продуктов реакции и, наконец, влияние на распад свободных радикалов, присутствующих в зоне реакции. [23]
При избытке кислорода образуется вода; в случае богатых смесей наблюдается дым. Это следует сопоставить с появлением ОН в бедных смесях и радикалов углерода в смесях с избытком горючего, превышающим эквимолекулярное соотношение. Образование и распад свободных радикалов можно проследить фотометрически. В периоде индукции происходит повышение температуры, на что указывает распределение интенсивностей в колебательно-вращательной структуре у-полос N0, образующейся из сенсибилизатора, а также то, что вслед за начальным периодом медленного повышения температуры следует ее экспоненциальный рост, приводящий к воспламенению смеси. Углеродные радикалы образуются в результате последующего крекинга избытка углеводорода, а бурный выход гидроксила в бедных смесях обусловливается последующим горением водорода. В предпламенных реакциях, происходящих в периоде индукции, наблюдается только слабый спектр гидроксила: таким образом, это единственный радикал, принимающий участие в предпламенных цепных реакциях углеводородов с кислородом. [24]
При избытке кислорода образуется вода; в случае богатых смесей наблюдается дым. Это следует сопоставить с появлением ОН в бедных смесях и радикалов углерода в смесях с избытком горючего, превышающим эквимолекулярное соотношение. Образование и распад свободных радикалов можно проследить фотометрически. В периоде индукции происходит повышение температуры, на что указывает распределение интенсивностей в колебательно-вращательной структуре у-полос N0, образующейся из сенсибилизатора, а также то, что вслед за начальным периодом медленно го повышения температуры следует ее экспоненциальный рост, приводящий к воспламенению смеси. Углеродные радикалы образуются в результате последующего крекинга избытка углеводорода, а бурный выход гидроксила в бедных смесях обусловливается последующим горением водорода. В предпламенных реакциях, происходящих в периоде индукции, наблюдается только слабый спектр гидроксила: таким образом, это единственный радикал, принимающий участие в предпламенных цепных реакциях углеводородов с кислородом. [25]
Оно связано с разрушением карбонильных соединений. Тетраэтил-свинец мало влияет на возникновение реакций обоих типов, но, очевидно, воздействует на продукты термонейтральной реакции в некоторый момент между образованием продукта, вызывающего удар, и самим ударом. Следовательно, благодаря присутствию добавки самовозгорание тормозится и происходит нормальное горение. Возможно, что ТЭС вызывает распад свободных радикалов, образующихся при разложении перекисей. [26]
Страницы: 1 2