Расплав - гидроокись
Cтраница 1
Расплавы гидроокисей имеют преимущество, которого лишены солевые расплавы: ввод в горючее замедлителя. Поэтому эти системы всесторонне изучаются на предмет использования их в качестве реакторного горючего. Для этого имеется два серьезных ограничения: 1) растворимость UOs в гидроокисях и испытанных смесях гидроокисей довольно мала; 2) расплавы гидроокисей чрезвычайно коррозионноактивны и, контактируя с конструкционными материалами при температурах, желательных в высокотемпературных реакторах, выделяют водород. [1]
В расплаве гидроокиси натрия при температуре 700 С образуется Na3FeO3, разлагающийся до окиси железа FeO. [2]
В расплаве гидроокиси натрия при температуре 700 С образуется Na3Fe03, разлагающийся до окиси железа FeO. [3]
При использовании расплавов гидроокисей щелочнык металлов реакцию проводят при температуре около 200 С. О), или н КОН добавляют небольшое количество воды. Но обычно КОН почти всегда содержит достаточное количество влаги и плавится ттргг 200 С. [4]
Металлический натрий получают путем электролиза расплава гидроокиси или хлорида натрия или же восстановлением при нагревании гидроокиси, карбоната или хлорида натрия с различными восстановителями в атмосфере водорода или в вакууме. [5]
Металлический калий получают либо электролизом расплава гидроокиси или хлорида калия, либо восстановлением гидроокиси, карбоната или хлорида калия при нагревании с различными восстановителями в атмосфере водорода или в вакууме. [6]
Щелочные металлы в свободном состоянии получают электролизом расплавов гидроокисей или расплавов их солей ( см. § 2, гл. [7]
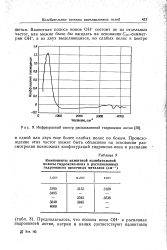 |
Инфракрасный спектр расплавленной гидроокиси лития. [8] |
Предполагалось, что полосы иона ОН - в расплавах гидроокисей лития; натрия и калия соответствуют валентным. [9]
Металлический натрий впервые был получен Дэви в 1807 г. путем электролиза расплава гидроокиси в платиновом электролизере ( он служил катодом) с анодом из платиновой проволоки. Название этого элемента происходит от арабского слова натрон или греческого нитрон, что означает сода. [10]
Щелочные металлы, будучи весьма химически активными, получаются главным образом при электролизе расплавов гидроокисей или хлоридов. [11]
Приведены результаты лабораторной и опытно-промышленной проверки очистки поверхности труб из титана, его сплавов и высоколегированных сталей в расплаве гидроокиси натрия, активированном электролизом. [12]
Особо чистый цирконий по своей коррозионной стойкости я кислотах приближается к танталу и превосходит последний по устойчивости в расплавах гидроокисей щелочных металлов. [13]
Химический метод основан на удалении смол и асфаль-тенов химическими реагентами, такими, как хлористоводородная, хлорсульфоновая, азотная, фосфорная кислоты, расплав гидроокисей щелочных металлов, раствор иода, в уксусной кислоте и др. Общим их недостатком является дороговизна, химическое взаимодействие со смолисто-асфальтено-выми веществами и невозможность регенерирования реагентов. [14]
Дегидратация Ва ( ОН) 2 8Н20 может производиться либо в сосуде, помещенном в нагретую до 300 - 320 С печь, либо на горячей поверхности частично погруженного в расплав дегидратируемой гидроокиси вращающегося барабана. Последний способ предпочтительней, так как удаление воды из тонкой пленки плава производится быстрее, а поэтому дегидратированная гидроокись бария получается более пористой и, следовательно, более активной при окислении. [15]
Страницы: 1 2