Расположение - поляризационная кривая
Cтраница 1
Расположение поляризационных кривых показано на фиг. [1]
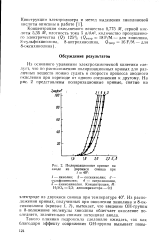 |
Поляризационные кривые на аноде из двуокиси свинца при. [2] |
Из основного уравнения электрохимической кинетики следует, что по расположению поляризационных кривых для различных веществ можно судить о скорости процесса анодного окисления при переходе от одного соединения к другому. [3]
На рис. 17, б показано влияние температуры электролита на расположение поляризационных кривых. [4]
Взаимодействие продуктов реакции влияет не только на равновесный потенциал, но и на расположение поляризационных кривых. А) может располагаться как при менее электроотрицательных, так и при более электроотрицательных потенциалах, по сравнению с поляризационной кривой восстановления только ионов компонента А из раствора с той же активностью ионов этого компонента. В первом случае говорят, что выделение компонента А совместно с компонентом Б происходит с деполяризацией, а во втором - со сверхполяризацией. [5]
Если же такие растворы или соединения образуются, то потенциал осаждения сплава может оказаться менее отрицательным, чем это следует из расположения поляризационных кривых, построенных отдельно для каждого металла. При малых плотностях тока преимущественно будет выделяться более благородный металл, но с увеличением плотности тока катодный потенциал становится все более отрицательным и в осадке увеличивается относительное количество более электроотрицательного металла. [6]
Рассматривая ход кривых, можно сделать вывод, что введение в раствор хлорида натрия, фторидов аммония и натрия, а также борной кислоты практически не влияет на расположение поляризационных кривых. [7]
Если в соответствии с уравнением ( XII, 12) принять, что при совместном разряде ионов скорости выделения металлов не меняются по сравнению со скоростью раздельного выделения их, то по расположению поляризационных кривых можно было бы определить относительное содержание металлов в сплаве в зависимости от потенциала. [8]
Однако из расположения поляризационных кривых ( кривая 5) следует, что 8-аминохннолин окисляется труднее хинолина. Это можно объяснить тем, что в кислой среде NH2 - rpynna проявляет основной характер и при переходе в МНз - группу вызывает понижение электронной плотности бензольного ядра, тем самым затрудняя отдачу электронов. [9]
Аналогичный эффект наблюдается для сульфата кадмия, для различных солей цинка и для сульфата цинка в присутствии нейтральных катионов. Однако порядок расположения поляризационных кривых для катионов при электролизе растворов кадмия и цинка не одинаков. [10]
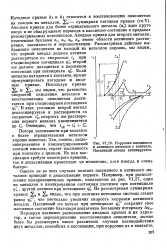 |
Коррозия пассивного и активного металлов в контакте. Пассивный металл активируется. [11] |
Однако не во всех случаях контакт пассивного и активного металлов приводит к депассивации первого. Например, при расположении поляризационных кривых, показанном на рис. VI17, один из металлов в изолированном состоянии пассивен при потенциале Фс другой активен при потенциале фс. Из рассмотрения суммарных кривых 2а и 2к видно, что при контакте потенциал системы станет равен фс, что несколько увеличит скорость коррозии активного металла. Пассивный же металл при потенциале фс сохранит свое пассивное состояние благодаря достаточно большому интервалу Афп. [12]
Из кинетики коррозионных реакций вытекает, что нельзя сравнивать коррозионную стойкость отдельных металлов и сплавов только по их месту в ряду напряжений. Решающим для их коррозионного поведения является ход и расположение поляризационной кривой, изображающей зависимость между электродным потенциалом и током, протекающим через границу электрод - электролит. На приведенной коррозионной диаграмме ( рис. 1, а) показана сумма отдельных катодных и анодных плотностей тока в виде поляризационной кривой, отвечающей поляризации электрода при прохождении внешнего тока. [13]
В опытах с тремя железными электродами было установлено, что параллельно со сдвигом катодных кривых в область положительных значений потенциалов наблюдается рост емкости двойного слоя. Если кривые 2 и 5, приведенные на рис. 7, пересчитать на исходную истинную поверхность электрода, то получается противоположный порядок расположения поляризационных кривых. Аналогичные результаты были получены и с двумя другими железными электродами. [14]
При переходе от (1.48) к (1.49) и (1.53) - (1.55) роль энергетического фактора падает, а кинетический все больше определяется транспортными свойствами электрохимически активных частиц. Из этого, однако, нельзя сделать вывод, что значение выбора материала электрода в измерении окислительного потенциала уменьшается, так как та или иная природа лимитирующей стадии электр одного процесса - это тоже проявление свойств материала электрода, его селективности. Для другого электродного материала, на котором оба конкурирующих процесса существенно тормозятся, можно получить иную картину расположения поляризационных кривых, что потребует другой оценки минимального значения / 0 Для реализации равновесных потенциалов. [15]
Страницы: 1