Тетраэдрическое расположение
Cтраница 3
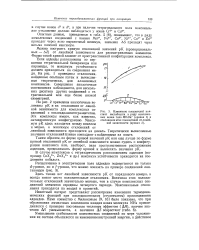 |
Изменение показателей констант нестойкости в ряду комплексных ионов типа MEdta - ( кривая / и отклонения этих показателей от линейной зависимости ( кривая 2. [31] |
В случае комплексов с тетраэдрическим расположением аддендов ( например СоХ42 -, ZnX42 - и др.) максимум устойчивости приходится на соединения кобальта. [32]
Модельное представление Вант-Гоффа о регулярно тетраэдрическом расположении четырех заместителей, соединенных с атомом углерода, ведет дальше, чем общие рассуждения ЛеБеля о симметрии. Оно подчеркивает определенное расположение, позволяет определить число возможных пространственноизомерных соединений и дает возможность сделать поддающиеся опытной проверке предположения относительно связи между строением и свойствами молекул. [33]
На рис. 118а показан мотив тетраэдрического расположения, причем и в данном случае тетраэдры соприкасаются по каждому ребру. [34]
Известно, что структура воды характеризуется тетраэдрическим расположением молекул: каждая молекула окружена четырьмя соседними, соприкасающимися с нею. [35]
 |
Орбитали rf J и rf V в октаэдрическом поле лигандов. [36] |
Рассмотрим действие лигандов на J-орбитали комплексообра-зователя при октаэдрическом и тетраэдрическом расположении лигандов. [37]
Fornaseri, 1949, 1950) н доказано тетраэдрическое расположение четырех групп, связанных с атомом бора. [38]
Электрическое поле растворенных ионов более или менее искажает тетраэдрическое расположение молекул воды, поскольку взаимодействие ион - вода значительно отличается от взаимодействия вода - вода. [39]
 |
Структурные параметры ионов [ SOX3 ].| Длины связей в некоторых соединениях серы. [40] |
Если шестивалентный элемент приобретает положительный заряд, возникает тетраэдрическое расположение связывающих пар только с одной я-связью. Типичными примерами являются ионы [ SOF3 ] ( 68) и [ SOMe3 ], структурные параметры которых приведены в табл. 10.20. Эти ионы по строению похожи на ионы [ 8Хз ], образуемые четырехвалентными атомами серы, где место неподеленной пары, занимает двойная связь сера - - кислород. [41]
Комплексы эти имеют цепочечную структуру с плоским или тетраэдрическим расположением аддендов около центрального иона. [42]
Как уже указывалось, четыре валентности атома углерода имеют тетраэдрическое расположение. Однако не всегда координационному числу 4 отвечает тетраэдрическое расположение связей. Например, ион IPdCUl имеет плоскую квадратную конфигурацию. [43]
Как уже указывалось, четыре валентности атома углерода имеют тетраэдрическое расположение. [44]
Как уже указывалось, четыре валентности атома углерода имеют тетраэдрическое расположение. SOl, POl и др.) - Однако не всегда координационному числу 4 отвечает тетраэдрическое расположение связей. Например, ион [ PdCl4 ] 2 - имеет плоскую квадратную конфигурацию. Возможны также различные значения валентных углов при окружении центрального атома 3, 5, 6 и большим числом соседей. Валентные углы несут важную информацию о природе химической связи, некоторые закономерности в их изменении будут рассмотрены в дальнейшем. [45]
Страницы: 1 2 3 4