Распределение - электрический заряд
Cтраница 1
Распределение электрических зарядов в коллоидной частице создает двойной электрический слой, характеризующийся ( - потенциалом, который для золя гидроксида железа положителен. [1]
Распределение электрических зарядов в коллоидной частице создает двойной электрический слой, характеризующийся - потенциалом, который для золя гидроксида железа положителен. [2]
Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения от сферически-симметричного является квадрупольныйрлектрический момент Q ядра. Если плотность заряда считается везде одинаковой, то Q определяется только формой ядра. [3]
Было установлено распределение электрического заряда в объеме протона. [4]
Различный характер распределения электрического заряда в молекулах позволяет разделить их на два основных класса - полярные и неполярные. К полярным молекулам относятся молекулы, обладающие важной электрической характеристикой - дипольным моментом. [5]
Различный характер распределения электрического заряда в молекуле позволяет разделить все молекулы на два основных класса - полярные и неполярные. К полярным молекулам относятся молекулы, обладающие электрическим дипольным моментом. [6]
При анализе распределения электрического заряда в первом приближении удобно рассматривать молекулу как систему валентных электронов и не участвующих в образовании молекулярных орбита-лей атомных остовов. Остов атома С1 имеет заряд 4 - 1, такой же, как и заряд протона. [7]
Для нахождения распределения электрических зарядов емкостей и соответственно напряжений на емкостях при статическом равновесии зарядов пользуются законом сохранения количества электричества и вторым законом Кирхгофа. [8]
 |
Кристаллическая структура алмаза. На рисунке показана тетраэдри-ческая система связей атомов в решетке. [9] |
Различие между распределением электрического заряда наглядно иллюстрирует рис. 52 для отдельных молекул, а рис. 53 показывает распределение заряда в кристалле с помощью картины эквипотенциальных линий. [10]
У ионных кристаллов распределение электрического заряда на поверхности значительно отличается от его распределения в объеме. В результате реакционная способность поверхности повышена к ионам противоположного заряда. [11]
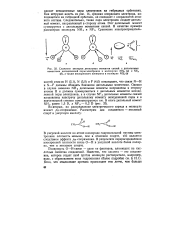 |
Сложение векторов дипольных моментов связей с дипольными моментами неподеленной пары электронов в молекулах NH3 ( а и NF8 ( б, а также неспаренного электрона в молекуле NOZ ( в. [12] |
Во-вторых, на распределение электрического заряда в молекуле влияет рп-сопряжение. [13]
 |
Сложение векторов моментов диполя связей с моментами диполя неподеленной пары электронов в молекулах NH3 ( а и NFa ( б, а также неспаренного электрона в молекуле NO2 ( в. [14] |
Во-вторых, на распределение электрического заряда в молекуле влияет ря-сопряжение. [15]
Страницы: 1 2 3 4