Распределение - молекула
Cтраница 2
Распределения молекул по проекциям и / скорости на оси координат ( / x y z) взаимно независимы. [16]
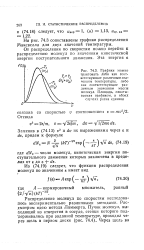
Распределение молекул по скоростям, полученное экспериментально, хорошо согласуется с теоретическим распределением, которое получил Максвелл еще в 1860 г., применив к тепловому, хаотическому движению законы теории вероятностей. Полученный им закон называется максвелловским распределением молекул по скоростям. Хорошее согласие теоретического закона с экспериментальными данными является отличным подтверждением правильности наших представлений о характере молекулярного движения в газах. [17]
Распределение молекул по уровням энергии зависит от состояния вещества и характера внешних возмущений. Функции распределения бывают равновесные и неравновесные. [18]
Распределение молекул по скоростям, выведенное впервые теоретическим путем выдающимся английским физиком Максвеллом, можно рассматривать как следствие закона Больцмана. [19]
Распределение молекул по скоростям исследова лось экспериментально различными методами. [21]
Распределение молекул по этим уровням определяется фактором Больцмана, exp ( - EJkT), где Ег - энергия перехода молекулы с самого нижнего уровня ( все четыре водородные связи не разорваны) на уровень i, а также внутренними степенями свободы движения каждого класса молекул. [22]
Распределение молекул по скоростям дается формулой Максвелла ( I860), которую мы сейчас рассмотрим, а распределение по энергиям - формулой Болыщана, рассматриваемой в следующем параграфе. [23]
 |
Кривые распределения молекул по скоростям при TiT2 и Т2Т3. [24] |
Распределение молекул в зависимости от скоростей движения изучали экспериментально. [25]
Распределение молекул по скоростям может быть представлено ( описано) таблицей или кривой. Оно даст нам сведения о том, какая доля молекул обладает той или иной скоростью. [26]
Распределение молекул по скоростям может быть представлено как функция отношения данной скорости к наивероятнейшей. При этом по оси ординат целесообразно откладывать отношение значения функции при данной скорости к значению при наивероятнейшей. Будет ли построенная таким образом кривая распределения пригодна для различных газов, разного числа молекул и разных температур или ее необходимо соответствующим образом перестраивать. [27]
 |
Ассоциированная пара молекул, уксусной кислоты.| Распределение молекул жидкости по скорости. [28] |
Распределение молекул по скорости показывает, что большая часть из них обладает скоростью, лишь на несколько процентов отличающейся от наиболее вероятной скорости; вместе с тем значительная часть молекул имеет очень малые скорости или, наоборот, очень большие скорости, и это обстоятельство приводит к ряду важных последствий. Молекулы жидкости обладают сходным распределением по скорости. На рис. 11.6 схематически представлены графики такого распределения при двух различных температурах. [29]
Распределение молекул красителя между жидкой фазой раствора реактива и слоем веществ в пятне лежит, по-видимому, в основе окрашивания липидов и липопротеинов водно-спиртовым раствором судана и аналогичных липофильных гистологических красителей. [30]
Страницы: 1 2 3 4