Распределение - скачок - потенциал
Cтраница 1
Распределение скачка потенциала в двойном электрическом слое, показанное на рис. 10, имеет место в тех случаях, если заряд электрода не меньше заряда ионов противоположного знака, прилегающих непосредственно к электроду, то есть если заряд плотной части двойного слоя не превышает заряда электрода и обусловлен электростатическим притяжением ионов к электроду. Однако ряд ионов способен притягиваться к поверхности электрода не за счет электростатических сил. Такие силы аналогичны силам притяжения атомов в молекулах с ковалентной связью, и при их наличии к поверхности электрода притягивается такое количество ионов, суммарный заряд которых неэквивалентен заряду металлической обкладки двойного слоя. Это явление носит название специфической адсорбции. При специфической адсорбции суммарный заряд ионов в плотной части двойного электрического слоя, противоположный по знаку заряду электрода, больше, чем заряд электрода. Эти плотно прилегающие к электроду ионы в свою очередь притягивают из раствора ионы того же знака, что и заряд электрода, и в диффузной части двойного слоя появляется избыток ионов с зарядом того же знака, что и заряд электрода. [1]
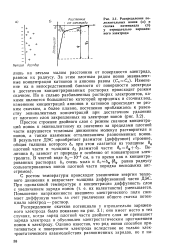 |
Распределение положительных ионов ( а и скачка потенциала ( б у отрицательно заряженного электрода. [2] |
Распределение скачков потенциала у отрицательно заряженного электрода было показано на рис. 3.1; оно имеет место в тех случаях, когда заряд плотной части двойного слоя не превышает заряда электрода и обусловлен электростатическим притяжением ионов к электроду. [3]
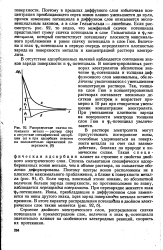 |
Распределение скачка потенциала металл - раствор ( Дф в отсутствие специфической адсорбции ( а и при адсорбции анионов на положительно заряженной поверхности ( б. [4] |
Строение двойного электрического слоя, распределение скачка потенциала в приэлетиродном слое, величина и знак - потенциала значительно влияют на особенности электродных реакций, скорость их протекания. [5]
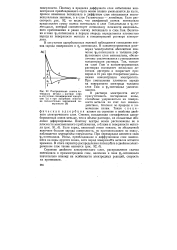 |
Распределение скачка потенциала металл - раствор ( Дф в отсутствие специфической адсорбции ( а и при адсорбции анионов на положительно заряженной поверхности ( б. [6] |
Строение двойного электрического слоя, распределение скачка потенциала в приэлектродном слое, величина и знак - потенциала значительно влияют / на особенности электродных реакций, скорость их протекания. [7]
Это свидетельствует, по-видимому, об определенном ьлиянии полупроводниковых свойств на распределение скачка потенциала на межфазной границе. [8]
В приведенных здесь и последующих уравнениях влияние строения ионного двойного слоя на распределение скачка потенциалов между металлом и раствором или на концентрацию реагирующего вещества в поверхностной фазе не учитывается. Предполагается, таким образом, что имеется избыток поверхностнонеактивного электролита. Последующие соотношения не зависят от выбранных выше условий, поскольку рассматриваются только наклоны кривых ток - потенциал в полулогарифмических координатах и соответствующее поведение псевдоемкости, обусловленной зависимостью степени покрытия промежуточными частицами от потенциала. [9]
В рассматриваемых электрохимических реакциях при высоких кислородных и озоновых потенциалах решающую роль в определении селективности и скорости процесса играют распределение скачка потенциала на границе фаз и состояние поверхности электрода: степень его окисленности, природа и количество адсорбированных на нем частиц, прочность их связи с поверхностью и реакционная способность в данных условиях. [10]
Хемосорбированные, или фазовые окисные слои, образуясь при определенных условиях на поверхности анода, изменяют электрохимические, адсорбционные, каталитические свойства поверхности электрода, приводят к изменению распределения скачка потенциала и, естественно, влияют на направление и скорость протекающих на аноде электрохимических процессов. [11]
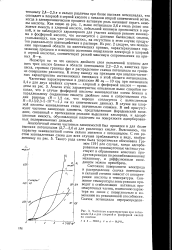 |
Частотные характеристики при потенциале 2 4 в для хлорной и фосфорной кислот на платине. [12] |
Несмотря на то что емкость двойного слоя окисленной платины для всех трех кислот близка в области потенциалов 2 2 - 2 5 в, кинетика процесса, строение границы фаз и распределение скачка потенциала на границе совершенно различны. К этому выводу мы приходим при анализе частотных характеристик составляющих импеданса в этой области потенциалов. В случае же хлорной кислоты эквивалентная схема значительно сложнее. В ней присутствуют частотно зависимые элементы, представляющие фарадеевский импеданс, связанный с протеканием реакции выделения кислорода, и адсорбционная емкость, обусловленная наличием на поверхности адсорбированных поляризованных диполей. [13]
 |
Кислородсодержащие поверхностные группы. [14] |
При анализе механизма электрокаталитического действия необходимо учитывать как химическое, так и электрохимическое строение межфазной границы. Химический состав поверхностных соединений определяет структуру активных центров, а распределение скачка потенциала на границе раздела оказывает существенное влияние на энергию активации электрокаталитической реакции. [15]
Страницы: 1 2