Знак - электрод
Cтраница 2
Запись ведут по схеме табл. 2; указывается знак электрода 6, стоящего перед диафрагмой, давление обозначается как положительное. [16]
 |
Стандартные электродные потенциалы в водных растворах при 25еС. [17] |
Собственному стандартному потенциалу электрода приписывается знак, соответствующий знаку электрода по отношению к стандартному водородному. При отрицательном знаке электрода ( ф 0) на нем происходит окисление Red - - Ox и ионы водорода восстанавливаются. [18]
 |
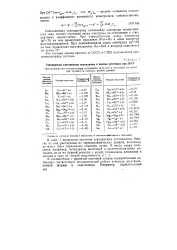
Схема для измерения потенциала металлического электрода.| Ряд напряжений некоторых элементов. [19] |
Измерения, согласно описанной схеме, дают возможность определить знак испытуемого электрода ( положительный или отрицательный) и численное значение его потенциала по сравнению с потенциалом водородного электрода. Потенциал водородного электрода принят равным нулю, поэтому измеренное напряжение характеризует скачок потенциала между испытуемым металлическим электродом и раствором соответствующей соли. В результате таких измерений составлен ряд напряжений. [20]
 |
Схема установки для определения потенциала течения. [21] |
В случае добавления 1 мг экв / л хлористого алюминия знаки электродов меняются. [22]
Установить, за счет энергии какой реакции работает гальванический элемент и знаки электродов. [23]
В гальваническом элементе, дающем электрическую энергию, са-копроизвольно протекающий химический или осмотический процесс определяет знак электродов и направление движения ионов. [24]
В некотарых случаях индикаторный электрод служит катодом, а электрод сравнения - анодом; в других случаях знаки электродов обратные. [25]
Вследствие действия электростатических сил у поверхности электрода, находящегося в растворе индифферентного электролита, происходит повышение концентрации ионов, знак заряда которых противоположен знаку электрода. Одни из этих ионов находятся у самой поверхности электрода и образуют так называемую плотную ( гельмгольцевскую) часть двойного слоя; другие же ионы, находящиеся на некотором расстоянии от поверхности, образуют его диффузную часть. Падение потенциала между электродом и точкой в глубине раствора распределяется между этими частями двойного слоя. Гельмгольца, отстоящей от поверхности электрода на расстоянии порядка радиуса гидра-тированного иона), то падение потенциала электрода, приходящееся на диффузную часть двойного слоя, не будет влиять на скорость переноса электронов. [26]
Знак заряда жидкости в таких приборах определяют по знаку, противоположному знаку того электрода, в сторону которого движется в приборе жидкость, а знак заряда порошка, являющегося диафрагмой Д в приборе, должен быть одинаковым со знаком электрода, к которому движется жидкость. [27]
Объяснение этого явления заключается в том, что при движении электролита может облегчаться протекание как анодного ( за счет удаления ионов растворяющегося металла из приэлект-родного слоя в глуоь раствора), так и катодного процесса ( например, за счет усиления подвода кислорода), и знак электрода определяется преобладанием одного эффекта над другим. [28]
Объяснение этого явления заключается в том, что при движении электролита может облегчаться протекание как анодного ( за счет удаления ионов растворяющегося металла из приэлект-родного слоя в глубь раствора), так и катодного процесса ( например, за счет усиления подвода кислорода), и знак электрода определяется преобладанием одного эффекта над другим. [29]
Конструкция ХИТ может быть самая различная, но в принципе и гальванические элементы и аккумуляторы состоят из двух электродов - проводников первого рода, разделенных слоем электролита - проводником второго рода. Знаки электродов и их название - анод и катод - соответствуют; протекающим на них окислительно-вос-становительнь м процессам. Так, при разряде ХИТ отрицательным электродом или анодом называется тот электрод, на Котором протекает процесс окисления, а положительным или катодом - - электрод, на котором идет процесс восстановления. При разряде свинцового аккумулятора отрицательным электродом является губчатый свинец, а положительным - электрод, состоящий из диоксида свинца. [30]
Страницы: 1 2 3 4