Рассмотрение - процесс - окисление
Cтраница 1
Рассмотрение процессов окисления и восстановления как переноса электрона, по-видимому, менее плодотворно для органических реакций. [1]
При рассмотрении процесса окисления пленок некоторые причины этих изменений становятся ясными. [2]
При рассмотрении процесса окисления жира особенно при температурах выше 70 обращает на себя внимание его стадийный характер. Первая стадия - начальный период, в течение которого окисление развивается сравнительно медленно, со слабо выраженным автоускорением. [3]
При рассмотрении процесса окисления пленок некоторые причины этих изменений становятся ясными. [4]
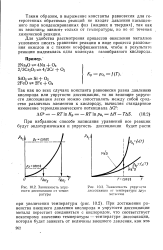 |
Зависимость упругости диссоциации от температуры.| Зависимость упругости. [5] |
Для удобства рассмотрения процессов окисления металлов условимся писать уравнения реакции в виде процесса разложения окислов и с такими коэффициентами, чтобы в результате реакции выделялась одна молекула газообразного кислорода. [6]
Возвращаясь к рассмотрению процесса окисления метана, мы видим, что молекула СН20 ( формальдегид) образуется в реакции Р13 ( табл. 1.15, реакция R6) как промежуточный продукт. При полном сгорании он будет разлагаться в ходе реакций R7 - R9 ( табл. 1.15), но если последовательность этих реакций прерьшается в результате химического или физического тушения, то среди продуктов реакции может остаться некоторое количество формальдегида. Подобным же образом может появиться и оксид углерода - наиболее распространенный продукт неполного сгорания. [7]
К аналогичным выводам приводит рассмотрение процесса окисления метплодсата в присутствии метнллинолеата [45]: с увеличением концентрации метнллинолеата в смеси резко возрастает скорость процесса. По-видимому, радикалы, образующиеся при окислении добавки мстиллннолеата, инициируют процесс окисления метилолеата. [8]
Изложенный механизм протекающих реакций может служить рабочей гипотезой при рассмотрении процесса окисления аммиака. [9]
При низкотемпературном Окислении ( при 225 С) поверхность железа покрывается окисной пленкой, состоящей из окисла железа Fe2O3 со структурой у. Наличие этой пленки необходимо учитывать при всех последующих нагревах при рассмотрении процессов окисления железа при повышенных и высоких температурах. При высоких температурах окисления первая и вторая стадии окисления заканчиваются весьма быстро в течение нескольких секунд. [10]
Особенно важное значение имеет кислотность среды. В результате процессов сольватации, и особенно сольволиза, растворитель всегда участвует в химических реакциях, вызывая протекание побочных реакций. В некоторых случаях реакциями сольволиза можно пренебречь ( например, при рассмотрении процессов окисления - восстановления), но в большинстве случаев, и особенно при расчете кислотно-основных равновесий, взаимодействие растворенного вещества с растворителем следует обязательно учитывать ( см. разд. [11]
Наглядное изображение различных сопротивлений, существующих при протекании газовых реакций в аппаратах с твердым катализатором, для общей реакции типа А В - R представлено на рис. VI-13. Зигзагообразные линии показывают величину сопротивлений, а стрелки - величину скорости процесса. На рис. VI-13 скорость гомогенной реакции показана пренебрежимо малой. В некоторых реакциях катализатор служит для образования свободных радикалов, вследствие чего гомогенная реакция протекает с очень большими скоростями, как показано нижней линией на рис. VI-13. Это последняя скорость не была включена при рассмотрении процесса окисления окиси азота. [12]
 |
Сопротивления, возникающие при проведении каталитической. [13] |
Наглядное изображение различных сопротивлений, существующих при протекании газовых реакций в аппаратах с твердым катализатором, для общей реакции типа A B - - R представлено на рис. VII-11. Зигзагообразные линии показывают величину сопротивлений, а стрелки - величину скорости процесса. На рис. VI1 - 11 скорость гомогенной реакции показана пренебрежимо малой. В некоторых реакциях катализатор служит для образования свободных радикалов, вследствие чего гомогенная реакция протекает с очень большими скоростями, как показано нижней линией на рис. VII-11. Это последняя скорость не была включена при рассмотрении процесса окисления окиси азота. [14]
Наглядное изображение различных сопротивлений, существующих при протекании газовых реакций в аппаратах с твердым катализатором, для общей реакции типа А В - R представлено на рис. VI-13. Зигзагообразные линии показывают величину сопротивлений, а стрелки - величину скорости процесса. На рис. VI-13 скорость гомогенной реакции показана пренебрежимо малой. В некоторых реакциях катализатор служит для образования свободных радикалов, вследствие чего гомогенная реакция протекает с очень большими скоростями, как показано нижней линией на рис. VI-13. Это последняя скорость не была включена при рассмотрении процесса окисления окиси азота. [15]
Страницы: 1