Расстояние - атом
Cтраница 2
Поскольку невозможно сблизить атомы на нулевое расстояние, то кривая потенциальной энергии в функции расстояния атома от его соседей идет круто вверх при малых расстояниях. В сторону уве - U личения расстояния кривая идет от положения равновесия ( дна ямы) много медленнее. Далее возможны варианты: потенциальная энергия на больших расстояниях может быть меньше и больше дна потенциальной ямы, - яма может иметь и не иметь четко выраженный борт. [16]
Мо в решетке молибдена, о - атомы Мо в решетке МозС; цифрами указаны расстояния атомов от плоскости чертежа; знаки показывают, что атом расположен над или под этой-плоскостью. [17]
Самый сильный максимум функции Q ( r) расположен в начале координат, он дает расстояния атомов до самих себя. Из ( 13) видно, что значение этого максимума в его вершине при г О определяется интегралом по квадрату электронной плотности данного объекта. Формулы ( 12) и ( 13) справедливы для любого объекта. [18]
Хорошим приближением к нормальному колебанию v, молекулы NH, является колебание, при котором изменяется только расстояние атома N от плоскости Н3, поэтому уровни энергии колебания va будут приближенно совпадать с уровнями одномерного осциллятора, двигающегося в потенциальном поле формы фиг. Применяя какое-либо аналитическое выражение потенциальной кривой, можно определить расщепление колебательных уровней i 4va как функцию соответствующих постоянных. Обратно, из наблюдаемых значений расщепления можно определить постоянные этой кривой и, в частности, расстояние между минимумами и высоту максимума. Оказалось, что значение расстояний между минимумами, полученное из вычислений, почти не зависит от конкретного вида потенциальной функции, принятого при расчете. Для высоты пирамиды NH3, равной половине расстояния между минимумами, найдено значение 0 38 10 - 8 см, что находится в полном соответствии со значением 0 381 10 - 8, полученным из инфракрасного враща-тельно-колебательного спектра ( см. гл. [19]
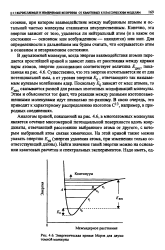 |
Энергетическая кривая Морзе для двухатомной молекулы. [20] |
Аналогом кривой, показанной на рис. 4.6, в многоатомных молекулах является сечение многомерной потенциальной поверхности вдоль координаты, отвечающей расстоянию выбранного атома от другого, с которым выбранный атом связан химически. [21]
При этом отдельные орбитальные угловые моменты электронов взаимодействуют с образованием результирующего углового момента, который связан с квантовым числом L, характеризующим расстояние атома в целом. Если спин-орбитальное взаимодействие велико, используется схема / - / - взаимодействия. При этом спиновые угловые моменты отдельных электронов сперва комбинируются с их орбитальными угловыми моментами с образованием суммарного углового момента / для отдельных электронов, а отдельные / взаимодействуют с образованием результирующего / всего атома. [22]
Фелич в своей теории диамагнитных явлений, равно как и Д вдарив говорят, что различие их от магнитных зависит от величины расстояния атомов между собою. [23]
Чтобы получить представление о внутренней работе, происходящей при нагревании твердых тел, и чтобы видеть зависимость ее от числа, веса и расстояния атомов, примем, что количество тепла, потраченное собственно для нагревания, в твердых телах то же самое, как и газообразных. [24]
 |
Энергии связи на решетке типа NaCl. [25] |
Шерман и Эйринг [48] показали с помощью квантово-мехапических расчетов, что энергия активации для хемосорбции водорода на угле в значительной мере зависит от расстояний атомов углерода друг от друга. Бик, Смит и Вилер [49] доказали экспериментально, что некоторые грани кристаллов обладают большей каталитической активностью, чем другие. Эти исследования будут обсуждены во II томе. Однако экспериментально никто еще не измерял теплоты адсорбции на определенной грани кристалла. [26]
 |
Энергии связи на решетке типа NaCl. [27] |
Шерман и Эйринг [48] показали с помощью квантово-механических расчетов, что энергия активации для хемосорбции водорода на угле в значительной мере зависит от расстояний атомов углерода друг от друга. Бик, Смит и Вилер [49] доказали экспериментально, что некоторые грани кристаллов обладают большей каталитической активностью, чем другие. Эти исследования будут обсуждены во II томе. Однако экспериментально никто еще не измерял теплоты адсорбции на определенной грани кристалла. [28]
Необходимо, таким образом, рассматривать адсорбированную молекулу не изолированно, а совместно с адсорбентом, как одну систему, потенциальная энергия которой есть функция расстояний атомов друг от друга ГА-А и от поверхности твердого тела R. Подобное рассмотрение требует перехода от двухмерной диаграммы кривых потенциальной энергии к трехмерной схеме поверхностей потенциальной энергии, аналогичных тем, которые строятся для случая взаимодействия трех атомов при химических реакциях. [29]
Другой путь представления зависимости потенциальной энергии С02 от деформационной координаты состоит в том, что она строится как функция расстояния О - О ( х) и расстояния атома С от оси О - О ( у) в предположении, что оно должно быть в плоскости, перпендикулярной оси О - О и проходящей через среднюю точку линии О - О. Это сделано на фиг. Ось абсцисс ( у 0) соответствует диагонали а - а на фиг. [30]
Страницы: 1 2 3 4