Наиболее вероятное расстояние - электрон
Cтраница 1
Наиболее вероятное расстояние электрона от ядра точно совпадает с радиусом первой боровской орбиты. [1]
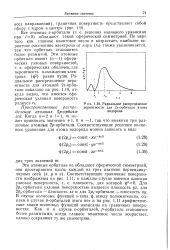 |
Радиальное распределение. [2] |
По мере того как главное квантовое число п возрастает, наиболее вероятное расстояние электрона от ядра ( гс) также увеличивается, так что орбиталь становится более размытой. [3]
Так, если вспомнить водородоподобные атомы, то для орбитали Is наиболее вероятное расстояние электрона от ядра равно а0 / Z, где а0 - борове-кии радиус ( 0 529 A), Z - заряд ядра, так что для атома углерода, если подобная оценка годится, это расстояние будет - 0 09 А, а для атомов с большими величинами Z - и того меньше. Эти орбитали с наиболее низкими каноническими орбитальными энергиями для более высоких по энергии орбиталей играют роль своего рода оболочки, экранирующей ядро атома. Низшие по энергии, сильно локализованные орбитали называются обычно остовными орбиталя-ми, а более высокие - валентными. Название валентные связано с тем, что именно эти атомные орбитали служат основой построения молекулярных орбиталей, дают в них главный вклад, тогда как остовные орбитали при образовании молекулы из атомов в существенной степени сохраняют свой атомоподобный характер. Если при рассмотрении молекулярных задач в качестве базиса берутся лишь валентные орбитали, а остовные орбитали учитываются лишь косвенно - через эффективные заряды ядер атомов, то такое приближение и носит название валентного. [4]
Из этой формулы следует, что выражение R nlr2 представляет собой плотность вероятности нахождения электрона на расстоянии г от ядра. На рис. 22.3 приведены графики плотности вероятности для различных состояний водородного атома. На рисунке видно, что наиболее вероятные расстояния электрона от ядра совпадают с радиусами соответствующих боровских орбит. [5]
Квантовая механика не дает столь точного описания движения электронов в атоме, как это сделал Бор. Однако свойства атома, поддающиеся измерению, точно описываются квантовомеханическими уравнениями. Эти свойства включают, например, среднее и наиболее вероятное расстояние электрона от ядра в определенном квантовом состоянии, а также среднюю скорость движения электрона. Установлено, что наиболее вероятное расстояние электрона от ядра и средняя скорость ( средняя квадратичная скорость) точно соответствуют расчетам Бора. Момент количества движения, однако, отличается, и, в частности, электрон атома водорода в нормальном состоянии не движется вокруг ядра по орбите с моментом количества движения П, а движется по направлению к ядру и от ядра по орбите с моментом количества движения, равным нулю. [6]
В заключение отметим, что квантовая механика не дает столь наглядного описания движения электронов в атоме, как это сделал Бор. Однако свойства атомов, поддающиеся измерениям, точно описываются квантовомеханическими уравнениями. Эти свойства включают, в частности, среднее и наиболее вероятное расстояния электрона от ядра в данном квантовом состоянии, а также среднюю скорость движения электрона. [7]
Но бессилие теории Бора количественно подойти к вопросу о структуре и свойствах сложных атомов, к вопросу о природе химической связи и др. показывает, что законы движения электронов гораздо сложнее, чем это описывается теорией Бора. Нельзя говорить о какой-то строго определенной орбите электрона; нам известно лишь среднее, наиболее вероятное расстояние электрона от ядра. [8]
Квантовая механика не дает столь точного описания движения электронов в атоме, как это сделал Бор. Однако свойства атома, поддающиеся измерению, точно описываются квантовомеханическими уравнениями. Эти свойства включают, например, среднее и наиболее вероятное расстояние электрона от ядра в определенном квантовом состоянии, а также среднюю скорость движения электрона. Установлено, что наиболее вероятное расстояние электрона от ядра и средняя скорость ( средняя квадратичная скорость) точно соответствуют расчетам Бора. Момент количества движения, однако, отличается, и, в частности, электрон атома водорода в нормальном состоянии не движется вокруг ядра по орбите с моментом количества движения П, а движется по направлению к ядру и от ядра по орбите с моментом количества движения, равным нулю. [9]
Страницы: 1