Раствор - нуклеиновая кислота
Cтраница 1
Растворы нуклеиновых кислот бесцветны, они не имеют полос поглощения в видимой части спектра, однако в ультрафиолетовой области они имеют характерный максимум поглощения в области 2600 А. Изучение поглощения в ультрафиолетовой части спектра проводится с помощью спектрофотометра или фотоэлектроколориметра ФЭК-Н, снабженного ультрафиолетовым осветителем. [1]
Раствор нуклеиновых кислот пропускают через колонку со скоростью около 1 мл / мин. При этих условиях тРНК, ДНК, рРНК и иРНК адсорбируются на колонке количественно. [2]
При нагревании раствора нуклеиновой кислоты спираль разворачивается и цепи разъединяются. [3]
При воздействии радиации на растворы нуклеиновых кислот в присутствии кислорода в качестве первичных продуктов радиационного повреждения образуются гидропероксиды нуклеиновых оснований. [4]
Хорошо известно, чю растворы нуклеиновых кислот и полипептидов обладают оптической активностью, значительно отличающейся от суммарной оптической активности мономерных звеньев. Это различие обусловлено спиральной структурой соответствующих макромолекул в на-тивном состоянии. Дисперсия естественной вращающей способности спиральных полимеров отличается от обычной дисперсии Друде. [6]
В отдаленные сроки после облучения вязкость растворов нуклеиновых кислот восстанавливается. [8]
Как уже упоминалось, ультрафиолетовое излучение приводит к изменению или потере биологической активности нуклеиновых кислот. Добавление в раствор нуклеиновой кислоты перед облучением небольших количеств ( 10 - 7 - 10 - 5 М) акридинового оранжевого302, профлавина 303 304, атебрина, акрифлавина или акридина305, образующих комплексы с нуклеиновыми кислотами, приводит к значительному снижению степени фотоинактивации. [9]
Разрыв водородных связей внутри спирали является следствием химических изменений в полинуклеотидных цепях; несколько водородных связей могут быть разорваны вследствие одного химического изменения. Были исследованы некоторые детали гиперхроматического эффекта, наблюдающегося при действии радиации на растворы нуклеиновых кислот. Этот эффект вызывается обычно изменениями среды вокруг хромофорных групп пуриновых и пиримидиновых оснований ДНК и обусловлен переменой характера водородных связей между основаниями внутри спиральной структуры. Изменение выражается в том, что вместо водородных связей, соединяющих основания, находящиеся в двух соседних спиральных цепочках, возникают водородные связи между этими основаниями и молекулами воды, когда последние проникают между цепочками спиральной структуры. [10]
Верхнюю фракцию осторожно отсасывают с помощью шприца в колбу. Повторяют обработку хлороформом и изоамиловым спиртом еще 2 - 3 раза, пока раствор нуклеиновых кислот не станет прозрачным. Полученный раствор отсасывают и медленно выливают в стакан с двойным объемом охлажденного 96 % - ного этилового спирта, помешивая при этом спирт круговыми движениями. Выпадают белые спиралевидные образования - нуклеиновые кислоты. Для более полного осаждения раствор переливают из стакана в стакан. Спиралевидные нити осторожно переносят палочкой в стакан с небольшим количеством 70 % - ного этилового спирта, повторяя операцию 2 - 3 раза с новыми порциями спирта. Затем нуклеиновые кислоты промывают сначала смесью спирт-эфир ( 1: 1), затем эфиром и оставляют сушиться при комнатной температуре. [11]
Для фракционирования тРНК широко используют анионо-обменную хроматографию. При низкой ионной силе тРНК, представляющие собой полианион, легко связываются с положительно заряженными группами DEAE-целлюлозы или DEAE-сефа-декса. Первый метод обычно используют для концентрирования растворов нуклеиновых кислот. Взаимодействие тРНК с DEAE-целлюлозой обусловлено не только ионным обменом, но и образованием множества водородных связей между молекулой тРНК и матриксом целлюлозы. [12]
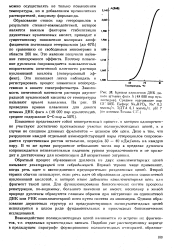 |
Кривая плавления ДНК дикого штамма фага А ( 48 000 пар нук-леотидов. Среднее содержание пар GC 50 %. Буфер. Na2HP04, Na 0 2 ммоль / л, ЭДТА 0 1 ммоль / л. рН 7 ( по данным Лохова С.Г. [13] |
Образование стопок пар гетероциклов в результате стекинг - взаимодействий, которое является важным фактором стабилизации двунитевых нуклеиновых кислот, приводит к существенному понижению молярных коэффициентов экстинкции гетероциклов ( до 40 %) по сравнению со свободными мономерами в области 260 нм. Это позволяет легко наблюдать и регистрировать процесс плавления непосредственно в кювете спектрофотометра. Зависимость оптической плотности раствора двуспи-ральной нуклеиновой кислоты от температуры называют кривой плавления. [14]
Страницы: 1