Раствор - нитрит
Cтраница 3
Если смешать раствор нитрита с такими сильными окислителями, как КМпО4 или NaCIO, то NOr ведет себя как восстановитель и окисляется до NOr. Но если раствор нитрита подкислить и смешать с иодид-ионом ( J -), то МОГ ведет себя, как окислитель. Сернистый газ, который применяется главным образом как восстановитель, приобретает свойства окислителя при изменении рН среды. [31]
Однако подкислять раствор нитрита недопустимо, так как при этом образуются летучие оксиды - одноокись и двуокись азота. Поэтому подкисляют раствор перманганата калия и к определенному объему его, взятому в избытке, приливают известный объе. По завершении этой реакции, идущей довольно медленно, к смеси добавляют иодид калия, который избыточным перманганатом окисляется до свободного иода. Последний оттитро-вывают рабочим раствором тиосульфата натрия. [32]
Когда весь раствор нитрита будет добавлен, реакционную смесь дополнительно перемешивают еще в течение нескольких минут, после чего 3, 5-ди-нитробензоилазид осаждают, добавляя 300 мл воды, в виде тонких белых кристаллических иголок. Твердый осадок собирают, тщательно промывают водой и сушат в вакуум-эксикаторе над серной кислотой. Это соединение нерастворимо в воде, слабо растворяется в холодном спирте, петролейном эфире и четыреххлористом углероде и хорошо растворяется в этих растворителях при нагревании. Динитробензоилазид хорошо растворяется в ацетоне, этилацетате, хлороформе, бензоле, толуоле и ледяной уксусной кислоте. [33]
По расходу раствора нитрита находят количество нитросоеди-нения, содержавшееся в навеске. [34]
Скорость прибавления раствора нитрита должна соответствовать скорости реакции диазотирования. При слишком быстром прибавлении нитрита в растворе накапливается много азотистой кислоты, которая может частично разлагаться, что неизбежно приведет к искажению результатов анализа. [35]
Для приготовления раствора нитрита растворяют 3 6 г NaNO2 или 4 5 г KNOa и 20 г хим. чист. В этот момент уже имеется небольшой избыток нитрита, который удаляют, приливая по каплям раствор КМпО4 до появления неисчезающей розовой окраски. [36]
При добавлении раствора нитрита к подкисленному раствору KI выделяется иод, окрашивающий раствор в желтый цвет. При взбалтывании такого раствора с хлороформом последний окрашивается в красно-фиолетовый цвет. [37]
Выбор концентрации раствора нитрита зависит от нескольких факторов: легкости нитрозирования, резкости конечной точки титрования, нестойкости азотистой кислоты. При использовании разбавленных растворов нитрита конечная точка менее отчетлива, однако меньше потери азотистой кислоты. [38]
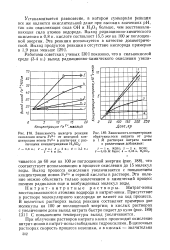 |
Зависимость выходов реакции окисления ионов Fe2 от исходной концентрации ионов Fe2 в растворах с различными концентрациями H2SO4.| Зависимость концентрации. [39] |
При облучении растворов нитрита калия происходит окисление нитрит-ионов в нитрат-ионы свободными гидроксилами. [40]
При титровании раствором нитрита индикатором служит иод-крахмальная бумага ( см. стр. [41]
В конце титрования раствор нитрита прибавляют медленно, по каплям. [42]
В конце титрования раствор нитрита прибавляют по капле и берут пробы для определения точки эквивалентности ( конца диазоти-рования) - каплю раствора стеклянной палочкой наносят на полоску иодидкрахмальной бумаги. Титрование можно считать законченным, когда капля раствора, взятая через 10 мин после введения очередной порции раствора нитрита, окрашивает иодлдкрахмаль-ную бумагу. [43]
В конце титрования раствор нитрита прибавляют медленно, по каплям. [44]
Можно также вводить раствор нитрита в подкисленный титрованный раствор КМпО4, взятый в избытке. Избыток КМпО4 затем определяют иодометрически. [45]
Страницы: 1 2 3 4