Раствор - перхлорат - натрий
Cтраница 2
Формальный электродный потенциал пары Pb2 / Pb ( Hg) в 0 1 М растворе перхлората натрия в диметилформамиде ( ДМФ) равен - 0 03В относительно электрода сравнения Ag / AgCl / 0 lM хлорид тетраэтиламмония ( ХТЭА) в ДМФ. Необходимо выразить ее потенциал относительно водного НКЭ без диффузионного потенциала. Формальный электродный потенциал пары Tl / Tl ( Hg) в 0 1 М растворе перхлората натрия в диметилформамиде составляет - 0 07 В относительно электрода сравнения Ag / AgCl / ХТЭА. В, который, как полагают, не зависит от растворителя. Вычитая 0 39 В из указанного выше потенциала пары Pb2 / Pb ( Hg), получаем - 0 42 В, который является потенциалом этой пары в ОД М растворе перхлората натрия в диметилформамиде относительно водного НКЭ без диффузионного потенциала. Поправочный коэффициент состоит из двух частей: 1) диффузионного потенциала между насыщенным хлористым калием в воде и 0 1 М раствором перхлората натрия в диметилформамиде и 2) разности потенциалов между водным НКЭ и электродом сравнения Ag / AgCl / ХТЭА в ДМФ. [16]
Россотти [26] спектрофотометричесним и потен-циометрическим методами было исследовано поведение ионов четырехвалентного ванадия в ЗМ растворе перхлората натрия. [17]
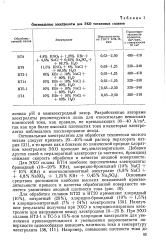 |
Оптимальные электролиты для ЭХО титановых сплавов. [18] |
Оптимальным электролитом для обработки технически чистого титана следует признать 20 - 40 % - ный раствор перхлората натрия [31 ], в то время как в близком по химической природе хлорат-ном электролите ЭХО проходит неудовлетворительно. Добавки других солей в перхлоратный электролит ( в частности, бромидов) снижают скорость обработки и качество анодной поверхности. [19]
Для подтверждения проведенных рассуждений сопоставим температурные зависимости относительной скорости релаксации при различных концентрациях электролита в растворах перхлората натрия и хлорида цезия. Обе эти соли характеризуйся высокой растворимо-ртью, обе составлены из ионов, один из которых при комнатной температуре является отрицательно гидратируемым, другой - слабо положительно гидратируемым. [20]
Были также проведены опыты по сочетанию упругих колебаний с закачкой химреагента, в качестве которого использовался раствор перхлората натрия. [21]
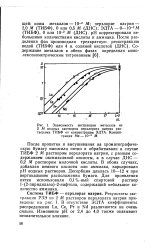 |
Зависимость экстракции металлов из 2 М водных растворов перхлората натрия растворами ТИБФ от концентрации ЭДТА. Концентрация Me-Ю-2 М. [22] |
После пропитки и высушивания на хроматографиче-скую бумагу наносили пятно и обрабатывали в случае ТИБФ 2 М раствором перхлората натрия, с разным содержанием оксимасляной кислоты, а в случае ДНС - 0 2 М раствором молочной кислоты. В обоих случаях, добавляя немного кислоты или аммиака, варьировали рН водных растворов. [23]
Раствор рН 2: берут 10 мл раствора диметилдиоксима, 3 мл хлорной кислоты, 1 мл раствора перхлората натрия. [24]
Раствор рН 3: берут 10 мл раствора диметилдиоксима, 1 мл хлорной кислоты, 10 мл раствора перхлората натрия. [25]
Раствор рН 11: берут 10 мл раствора диметилдиоксима, 1 мл раствора щелочи, 10 мл раствора перхлората натрия. [26]
Раствор рН 12: берут 10 мл раствора диметилдиоксима, 10 мл раствора щелочи, 9 мл раствора перхлората натрия. [27]
Раствор рН 12: берут 10 мл раствора диметилдиоксима, 20 мл раствора щелочи, 8 мл раствора перхлората натрия. [28]
Раствор рН 2: берут 10 мл раствора диметилдиоксима, 3 мл хлорной кислоты, 1 мл раствора перхлората натрия. [29]
Раствор рН 3: берут 10 мл раствора диметилдиоксима, 1 мл хлорной кислоты, 10 мл раствора перхлората натрия. [30]
Страницы: 1 2 3 4