Раствор - полуколлоид
Cтраница 1
Растворы полуколлоидов имеют широкое распространение и ( все возрастающее практическое значение. Полуколлоиды - это также растворы многих красителей ( например, бензо-пурпурина) и дубильных веществ - таннинов. Остановимся кратко лишь на некоторых свойствах детергентов. [1]
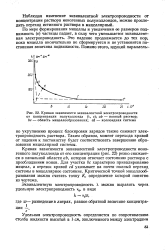 |
Кривая зависимости эквивалентной электропроводности. [2] |
Наблюдая изменение эквивалентной электропроводности от концентрации раствора ионогенных полуколлоидов, можно проследить переход истинного раствора в мицеллярный. [3]
Книга посвящена сложному и мало изученному вопросу - строению растворов поверхностноактивных полуколлоидов и представляет большой научный интерес в связи с принятым курсом на химизацию народного хозяйства и широким развитием синтеза и производства поверхностноактивных веществ. [4]
Книга посвящена сложному и мало изученному вопросу - строению растворов поверхностноактпвных полуколлоидов и представляет большой научный интерес в связи с принятым курсом на химизацию народного хозяйства и широким развитием синтеза и производства поверхностноактивных веществ. [5]
Коллоидное растворение, определяясь в значительной мере развитием мицеллярных структур растворов поверхностно-активных полуколлоидов, в свою очередь может оказывать на них глубокое влияние. [6]
К числу таких слабоструктурированных жидкостей принадлежат малоконцентрированные растворы высокомолекулярных соединений: белков, искусственных смол, каучука; растворы полуколлоидов; мыла, моющих и вспомогательных средств; некоторых красителей и пр. [7]
Дальнейшее увеличение концентрации раствора приводит к связыванию мицелл друг с другом и образованию геля. Конечно, эти представления о строении мицелл схематичны и реальная структура растворов полуколлоидов более сложна и различна для разных веществ. [8]
Эти результаты в сочетании с результатами температурной зависимости ККМ, реологических характеристик в соответствующих сопряженных системах, а также полученные приближенным расчетом небольшие положительные значения энтальпии внутримицеллярного растворения углеводородов ( ДЯ от 1 до б ккал / моль) в данном интервале температур позволяют заключить, что сама по себе солюбилизация углеводородов в водных растворах мыл, оставаясь ограниченной равновесной величиной, носит в основном энтропийный характер. Далее работами этих же сотрудников было показано, что коллоидная растворимость, определяясь в значительной степени мицеллярной структурой растворов поверхностно-активного полуколлоида, в свою очередь оказывает на нее резкое влияние. Такое влияние выражено тем более сильно, чем выше концентрация раствора. При этом солюбилизация углеводородов оказывает резкое разжижающее действие с понижением, например в растворах олеата натрия, наибольшей предельной вязкости в сотни тысяч раз, по-видимому, вследствие обратного превращения слоистых мицелл в сфероидальные стабилизованные мицеллы, не обладающие коагу-ляционными контактами на своей поверхности. [9]
Согласно теории, выдвинутой еще в 30 - е годы Ребинде-ром [ II ], основой моющего действия ПАВ и моющих средств является их поверхностная активность при достаточной механической прочности и вязкости адсорбционных пленок. Последнее условие выполнимо при оптимальной коллоидности растворов. Образовавшиеся пленки должны быть как бы твердыми за счет полной ориентации полярных групп в насыщенных адсорбционных слоях и коагуляции ПАВ в адсорбционной слое. Эти явления наблюдаются только в растворах поверхностно-активных полуколлоидов. [10]
Аналогичные явления, правда, в несколько иной обстановке, наблюдаются для некоторых коллоидных растворов - гидрозолей SiO, FeaOg, A12O8, V2O5 и др. Эти золи иногда в процессе хранения при неизменной температуре, сохраняя полную прозрачность, утрачивают текучесть и приобретают консистенцию полутвердой массы, которую можно резать ножом на куски, сохраняющие форму. Происходит желатинирование, золь переходит в гель. Образующиеся гели называют лиогелями в отличие от коагелей, возникающих, например, при электролитной коагуляции золей. Коагель возникает в результате разрушения, седиментации дисперсной системы с отделением дисперсной фазы от дисперсионной среды. В коагелях содержание диспергированного вещества достигает многих десятков процентов. В лиогелях содержание твердой фазы невелико, определяется концентрацией золя и обычно не превышает нескольких процентов или даже долей процента. При достаточной концентрации способны застудневать и растворы полуколлоидов. [11]
Страницы: 1