Раствор - любое вещество
Cтраница 1
Раствор любого вещества, приготовленный так, что известно точное содержание вещества в данном количестве раствора, называется стандартным раствором. [1]
Для выделения из раствора г-экв любого вещества требуется затратить 96540 к электричества. [2]
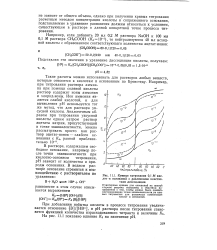 |
Кривые титрования 0 1 М кислот и оснований с ( различными константами диссоциации. [3] |
Такие расчеты можно использовать для растворов любых веществ, которые относятся к кислотам и основаниям по Бренстеду. Например, при титровании раствора аммиака при помощи соляной кислоты раствор содержит ионы аммония и хлорид-ионы. Ион аммония является слабой кислотой, и для вычисления рН используется тот же метод, что для раствора уксусной кислоты. [4]
Таким образом, повышение температуры кипения растворов любого вещества в данном растворителе определяется только числом молей вещества, растворенных в 1000 г растворителя. [5]
Удалить кислород полностью очень трудно; это легко продемонстрировать на растворе любого вещества с небольшими молекулами, как, например, бензол. Проделывайте над ним циклы замораживания-откачивания-размораживания и после каждого цикла проверяйте 7 ( быстрый метод определения Т, описан в гл. Обратите внимание, насколько долго нужно обезгаживать образец до получения постоянного Т1т Такой эксперимент, кроме того, позволит хорошо проверить ваше оборудование. Старайтесь проводить обезгаживание образца непосредственно перед измерением ЯЭО, поскольку кислород довольно быстро диффундирует внутрь образца даже в ампуле с краником. Очень полезно иметь вакуумную линию непосредственно в ЯМР-лаборатории. [6]
 |
Коэфициенты диффузии D ( в воду и желатину. [7] |
С другой стороны, из теории разбавленных растворов следует, что эквимолекулярные растворы любых веществ, приготовленные с одинаковыми весовыми количествами одного и того же растворителя, показывают одинаковые величины осмотического давления, понижения упругости пара, повышения точки кипения и понижения точки замерзания. [8]
Известно, что давление водяных паров ( так же, как и паров раствора любого вещества) определяется их температурой. [9]
Формула (3.62) применима к растворам, молекулярные массы компонент которых известны, а формула (3.63) - к растворам любых веществ, включая полимерные. [10]
Поскольку в данный момент мы интересуемся осмотическим давлением, постольку эта вторая формулировка о соотношении между температурой и давлением газа для нас представляет наибольший практический интерес. Следовательно, осмотическое давление раствора любого вещества прямо пропорционально температуре, и математическое выражение этому дано в вышеприведенном уравнении. [11]
Говоря о значении и роли особых точек Менделеева в отыскании определенных химических соединений в растворах, автор монографии писал: В руки химиков дан новый метод открытия веществ тем более драгоценный, что позволяет он открывать вещества наиболее непрочные из всех химических соединений. Именно исследуя любое физическое свойство растворов любого вещества и затем исследуя кривую, представляющую зависимость этого свойства от процентного состава, мы по изменению хода кривой имеем возможность открыть целый ряд молекулярных соединений между растворенным телом и растворителем. [12]
При изложении основных положений термодинамики пользуются определенными понятиями. Всякий материальный объект, состоящий из большого числа частиц ( молекул, атомов, ионов), условно отделяемый от окружающей среды, является термодинамической системой. Это может быть кристалл минерала, раствор любого вещества в какой-либо емкости, газ в баллоне. При взаимодействии системы с окружающей средой она может получать или отдавать энергию в виде теплоты или работы. [13]
Страницы: 1