Раствор - неполярное вещество
Cтраница 1
Растворы неполярных веществ в неполярных р а ств ор ите л.ях. Здесь молекулы веществ взаимно не влияют друг на друга и молекулярная поляризация раствора практически не зависит от концентрации. Примерами таких смесей могут служить смеси бензол - гептан, бензол - четыреххлористый углерод, гептан - сероуглерод. [1]
В растворах неполярных веществ основным взаимодействием является дисперсионное. [2]
Отсюда следует, что растворы неполярных веществ в большинстве случаев характеризуются положительными отклонениями от идеальности. Растворы веществ средней полярности, как правило, характеризуются отрицательными отклонениями от идеальности, если оба компонента раствора обладают близкими по величине обобщенными моментами или диэлектрическими постоянными. По мере увеличения полярности вещества область отрицательных отклонений от идеальности в общем растет, становясь наибольшей в некоторых растворах электролитов в неэлектролитах. [3]
Уравнение (1.65), выведенное для растворов неполярных веществ, оказалось пригодным и для растворов водорода и азота в воде. [4]
Уравнение (1.80), выведенное для растворов неполярных веществ, оказалось пригодным и для растворов водорода и азота в воде. [5]
Наблюдаемое ( см. рис. IV-34) для растворов неполярных веществ различие в характере изменения проницаемости объясняется следующим образом. При различной подвижности моЛекул компонентов смеси малоподвижные молекулы неполярного вещества частично блокируют вход в поры, а в порах сужают сечение потока жидкости. Поэтому в данном случае связанный слой проявляет свойства неньютоновских жидкостей [229], вязкость которых зависит от создаваемого напряжения сдвига, и течение этого слоя через поры начинается только при достижении определенного сдвигового напряжения - выше предельного. [6]
В настоящее время для объяснения аномальных свойств растворов неполярных веществ и органических электролитов весьма широко используется модель, предложенная Фрэнком и Вэном [89], согласно которой гидрофобные частицы в растворе не способны сильно взаимодействовать с диполями ближних молекул воды. В результате часть энергии высвобождается вследствие укрепления водородных связей между этими молекулами воды. Но, как указал Викке [90], в данной модели не учитываются объемный эффект и эффект замещения, дающие особенно большой вклад в энергетику гидратации нейтральных частиц. [7]
Наблюдаемое ( см. рис. 4 - 4) для растворов неполярных веществ различие в характере изменения проницаемости объясняется следующим образом. При различной подвижности молекул компонентов смеси малоподвижные молекулы неполярного вещества частично блокируют вход в поры, а в порах сужают сечение потока жидкости. [8]
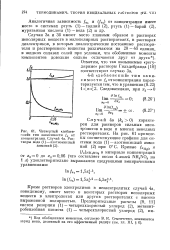 |
Четвертый дебаев-гкий тип зависимости / 0 от концентрации. Случай 4а. Растворы вода ( 1 - азотнокислый аммоний ( 2. [9] |
Кроме растворов электролитов в неэлектролитах случай 4а, невидимому, имеет место в некоторых растворах неполярных веществ в электролитах или других растворителях с высоко выраженной полярностью. [10]
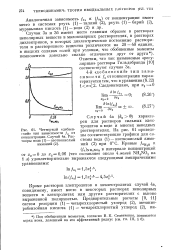 |
Четвертый дебаев - растворителях. На 61 приводе-скии тип зависимости / п от г Y. [11] |
Кроме растворов электролитов в неэлектролитах случай 4а, повидимому, имеет место в некоторых растворах неполярных веществ в электролитах или других растворителях с высоко выраженной полярностью. [12]
Общей количественной теории растворов пока не существует, имеются лишь с успехом разрабатываемые частные теории растворов неполярных веществ с молекулами, симметрия силового поля которых близка к шаровой, или разбавленных растворов электролитов. [13]
Однако сложность и разнообразие закономерностей, охватывающих свойства растворов различных веществ, делают теорию растворов труднейшей проблемой молекулярной физики и учения о химических связях. Общей количественной теории растворов пока не существует, имеются лишь с успехом разрабатываемые частные теории растворов неполярных веществ с молекулами, симметрия силового поля которых близка к шаровой, или разбавленных растворов электролитов. [14]
 |
Схема взаимодействия со - J. [15] |
Страницы: 1 2