Раствор - сероводород
Cтраница 2
Ионы Н в растворе сероводорода получаются и основном в результате диссоциации его по первой ступени. [16]
Слабая двухосновная кислота, раствор сероводорода в воде; применяется для получения сульфидов, в аналитической химии, в медицине. [17]
При наличии в анализируемом раствора сероводорода и меркаптанов наблюдается два последовательных скачка потенциала: первый отвечает содержанию вещества, обладающего более выраженными кислотными свойствами - оеров. [18]
Электрохимическая коррозия под действием растворов сероводорода применительно к оборудованию первичной переработки нефти рассмотрена в работах [2-5] и в гл. [19]
В результате контакта с растворами сероводорода в воде могут появляться на коже дерматиты и экземы папулезного или пузырькового характера. [20]
Например трихлорпарафин нагревают с раствором сероводорода в едком кали под давлением при 140, причем получаются инсектисиды. [21]
В колбочки Эрленмейера налить отдельно растворы сероводорода и краски индиго, всыпать в каждую из них по 1 г мелко измельченного угля и энергично взбалтывать содержимое колбочек. [22]
Углеродистая сталь, погруженная в раствор сероводорода, ведет себя несколько иначе. После выпадения из среды осадка сульфида железа, что свидетельствует о достижении раствором рН 4 0 - 4 5, электродный потенциал металла стабилизируется во времени и в последующем ( 4 - 26 суток) практически не изменяется. По-видимому, это обусловлено стабилизацией рН среды, достигаемой в процессе периодического насыщения электролита сероводородом. Как видно из данных рис. 22, горизонтальное или вертикальное расположение образцов в исследуемой среде не сказывается существенно на величине потенциала стали. Электродный потенциал углеродистой стали в электролите, насыщенном сероводородом, устанавливается в пределах 0 43 - 0 44 в, что согласуется с данными [1, 90, 91, 10, 92], полученными для железа и малоуглеродистой стали в подкисленных до рН 4 0 - 5 0 электролитах и минерализованных средах. Это указывает на то, что в слабокислых средах, насыщенных сероводородом, электродный потенциал железа или стали, по-видимому, имеет одну и ту же природу. [23]
Почему при добавлении KaS к раствору сероводорода уменьшается концентрация ионов водорода. [24]
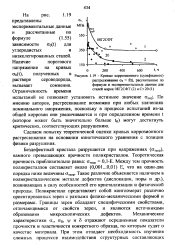 |
Кривые коррозионного ( сульфидного растрескивания сто ОД, рассчитанные по формуле и экспериментальные данные для сталей марок 08Г2СФТ ( 2 и Ст20 ( 1. [25] |
О), полученных в растворе сероводорода, вызывает сомнения. [26]
Почему при добавлении К2 § к раствору сероводорода уменьшается концентрация ионов водорода. [27]
Действие газоанализатора основано на измерении светопогло-щения раствором сероводорода. [28]
Рассмотрим коррозионное растрескивание некоторых сталей в растворах сероводорода. [29]
Наличие трех зон коррозии цементного камня в растворах сероводорода, углекислоты и магнезиальных солей объясняется тем, что диффузионная подвижность НзО намного выше, чем HS, поэтому во внутреннюю ( центральную) зону проникают лишь ионы водорода, в следующую - НзО и HS, но не вымываются ионы Са, а в наружной происходит потеря этих ионов. [30]
Страницы: 1 2 3 4