Раствор - различное вещество
Cтраница 1
Растворы различных веществ или одного вещества в разных растворителях при прочих равных условиях различаются по ширине метастабильной области ( в значениях относительного пересыщения) в десятки раз. Существует несколько правил, описывающих связь устойчивости пересыщенных растворов с их свойствами. Так, согласно правилу Вант-Гоффа, чем больше произведение валентностей ионов, составляющих соль, тем легче образуются пересыщенные растворы. [1]
Растворы различных веществ, содержащие по одинаковому числу растворенных молекул, показывают ( при прочих равных условиях) одинаковое осмотическое давление, одинаковое повышение температуры кипения и одинаковое понижение температуры замерзания. [2]
Растворы различных веществ, ( которые содержат в равных объемах одинаковое число молекул, обнаруживают одинаковое осмотическое давление ( изотонические растворы), одинаковое понижение температуры замерзания и одинаковое повышение температуры кипения. [3]
Растворы различных веществ, имеющие одинаковую молярную концентрацию, называют равномолярными или эквимоляр-ными. [4]
Растворы различных веществ также относятся к числу смесей. [5]
Сопоставляя растворы различных веществ в одном и том же растворителе, Вант-Гофф теоретически предсказал, что растворы, имеющие одинаковое осмотическое давление, должны иметь одинаковую упругость пара и одинаковые точки кипения и затвердевания. [6]
В растворах различных веществ в жидких неводных растворителях и сжиженных газах помимо ионов, предсказываемых теорией электро -, литической диссоциации, имеются разнообразные ионы и молекулы, вызывающие аномалии в поведении истинных растворов, которые не могут быть объяснены ни гипотезой С. Онзагера, поскольку предметом их не является изучение влияния растворителей на свойства электролитов. Следует отметить, что теория Бренстеда и другие теории, предметом которых было исследование влияния растворителей на силу кислот и оснований, также не объясняют аномалий в поведении электролитов в неводных растворах. Как показывают исследования, указанные аномалии обусловливаются взаимодействием растворенного вещества с растворителем. [7]
Всесторонние исследования растворов различных веществ в жидких неорганических и органических растворителях и в сжиженных газах показали, что кислоты и основания существуют не только в водных растворах, где имеет место динамическое равновесие, устанавливаемое между ионами водорода и ионами гидро-ксила, но и в неводных растворах, в которых это равновесие отсутствует. [8]
Изучая электропроводность растворов различных веществ, Аррениус обратил внимание на то, что электрический ток проводят лишь водные растворы кислот, оснований и солей. [9]
Кроме того, растворы различных веществ, имеющие одинаковую мольную концентрацию, при одной и той же температуре имеют одинаковое осмотическое давление. Такие растворы называются изотоническими. [10]
Иными словами: эквимоляльные растворы различных веществ в одном и том же растворителе имеют одинаковую величину давления пара. Следовательно, понижение давления пара раствора зависит от соотношения количества частичек растворителя и растворенного вещества. [11]
Концентрационное тушение у растворов различных веществ, входящих в состав нефти: 1 - оиликагелевые смолы; г - масла; 3 - асфальтены. [12]
При опытах с растворами различных веществ было замечено, что растворимые кристаллические соединения, как сахар, хлорид натрия и другие соли, легко проходят через мембрану, а некристаллические или так называемые аморфные вещества, как желатина, кремневая кислота, альбумин, гидроокись железа, или совсем не диффундируют или диффундируют очень медленно. [13]
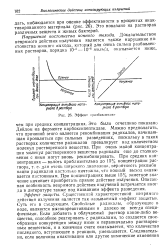 |
Эффект разбавления. [14] |
Это показано на растворах различных веществ и живых бактерий. [15]
Страницы: 1 2 3 4