Раствор - соль
Cтраница 2
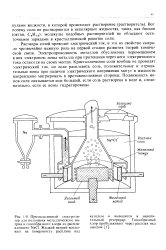
Раствор соли из колонны 4 направляется в выпарной аппарат 5, обогреваемый паром. Далее раствор поступает в аппарат 7 для насыщения аммиаком. Маточный раствор, содержащий аммиачную селитру, из аппарата 7 и центрифуги 8 поступает в сборник жидких аммиакатов 6, a затем к потребителю. [16]
Раствор соли помещают в тонкостенный стакан и прибавление сульфомассы производят при хорошем перемешивании деревянной лопаточкой. [17]
 |
Промышленный электролизер для получения металлического натрия и газообразного хлора из расплавленного NaCl. Жидкий натрий всплывает на поверхность расплава над. [18] |
Растворы солей проводят электрический ток, и это их свойство сыграло чрезвычайно важную роль на первой стадии развития теорий химической связи. Электропроводность металлов обусловлена перемещением в них электронов; ионы металла при протекании через него электрического тока остаются на своих местах. Кристаллические соли вообще не проводят электрический ток, но если расплавить соль, положительные и отрицательные ионы при наличии электрического напряжения могут в жидкости направленно мигрировать в противоположные стороны. Подвижность ионов соли оказывается еще большей, если соль растворена в воде и, следовательно, если ее ионы гидратированы. [19]
Растворы солей в воде имеют фиолетово-красный цвет. [20]
Растворы солей ( красные или красно-фиолетовые) выпаривают досуха; образуются хорошо кристаллизующиеся, окрашенные, очень жадно притягивающие влагу вещества. [21]
Растворы солей гафния ведут себя аналогично растворам солей циркония, но рН начала осаждения немного выше для гафния при эквивалентных концентрациях металлических ионов. [22]
Раствор соли, полученный при разложении фосфорита азотной кислотой, предварительно охлаждается в поверхностном теплообменнике до 25 С, затем подается в верхнюю часть кристаллизатора. Здесь он охлаждается до более низкой температуры, проходя через слой не смешивающегося с ним охлаждающего агента. Агент ( в данном случае это нефть, несодержащая ненасыщенных и ароматических углеводородов) подается циркуляционным насосом 3 в специальный теплообменник 2, где охлаждается испаряющимся аммиаком до - 15 С. Охлажденная нефть вводится под центральную трубу 6 в нижней части кристаллизатора через специальное распределительное устройство 5, из которого выходит в виде отдельных капель. Вследствие малой плотности нефти капли поднимаются вверх, отнимая тепло от окружающего водного раствора и вызывая его циркуляцию. [23]
Растворы солей, образованных сильными основаниями и слабыми мнргооснрвньши кислотами, имеют щелочную реакцию. Расчет рН и степеней гидролиза в растворах солей мнргооснрвных слабых кислот аналогичен расчету для растворов одноосновных слабых кислот. [24]
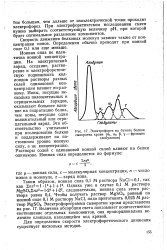 |
Электрофорез на бумаге белков. [25] |
Растворы солей с одинаковой ионной силой влияют на белки одинаково. [26]
Растворы солей уранила легко растворяют UO3 с образованием подобных сложных ионов. Процессы осаждения довольно сложны. Истинная растворимость для основных условий осаждения не найдена, поскольку равновесие наступает не сразу. [27]
Раствор соли K2Ni ( CN) 4 можно получить перед самым определением титрованием цианида калия солью никеля в присутствии мурексида ( см. определение цианида в предыдущем параграфе), что не очень удобно при проведении серийных определений. Для получения этой соли лучше всего пользоваться следующей прописью: 20 г сульфата никеля ( NiSO4 - 7H2O) растворяют в 50 мл воды и прибавляют при энергичном перемешивании 20 г твердого цианида. Образуется желтый раствор, из которого выделяется сульфат калия. Последний извлекают из раствора почти полностью прибавлением 100 мл спирта. После фильтрования под вакуумом фильтрат упаривают почти досуха. Образуется твердая кристаллическая соль, которую смешивают с 50 мл спирта, после охлаждения фильтруют и дважды промывают 3 мл спирта. Затем тонкие игольчатые кристаллы растворяют в большой чашке и оставляют на несколько дней на воздухе, освобожденном от пыли. В течение этого времени последние следы цианида переходят в карбонат. Образовавшийся продукт не совсем чист, так как содержит незначительное количество сульфата калия, но имеет точный стехиометрический состав, который проверяют следующим образом: две порции по 100 мг приготовленного препарата растворяют в 10 мл воды, к которой предварительно прибавляют 0 5 мл разбавленного раствора аммиака. После добавления небольшого количества мурексида появляется красная окраска. Если прибавить к одному из растворов одну каплю 0 01 М раствора сульфата никеля ( или нитрата серебра), то красная окраска должна перейти в желтую. Второй раствор от одной капли 0 01 М раствора комплексона должен окраситься в темнофиолетовый цвет. [28]
Раствор соли очень мало окисляется кислородом воздуха, при стоянии на воздухе выделяет желтый осадок основной соли. [29]
Раствор соли от прибавления разведенной серной кислоты выделяет желто-бурые пары окислов азота. [30]
Страницы: 1 2 3 4