Раствор - соль - кальций
Cтраница 1
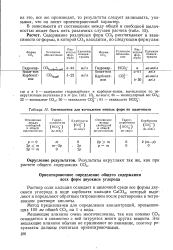 |
Соотношения для вычисления ионных форм по щелочности. [1] |
Раствор соли кальция осаждает в щелочной среде все формы двуокиси углерода в виде карбоната кальция СаСОа, который выделяют и определяют обратным титрованием после растворения в титрованном растворе кислоты. [2]
Раствор соли кальция разбавляют таким образом, чтобы в 100 мл его содержалось не более 50 мг Са. Раствор сильнр подщелачивают едким натром до рН не менее 12 и после прибавления 0 3 мл свежеприготовленного насыщенного раствора мурексида титруют раствором комплексона до изменения цвета от красного до сине-фиолетового. [3]
Раствор соли кальция осаждает в щелочной среде все формы двуокиси углерода в виде карбоната кальция СаСО3, который выделяют и определяют обратным титрованием после растворения в титрованном растворе кислоты. [4]
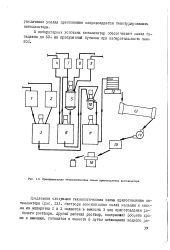 |
Принципиальная технологическая схема приготовления катализатора. [5] |
Растворы азотнокзслых солей кальция и никеля из аппаратов I и 2 подаются в емкость 3 для приготовления рабочего раствора. [6]
 |
Кристаллы г. -. J г А о с 94. [7] |
К раствору соли кальция добавляют каплю насыщенного раствора селенита натрия. Осаждается селенит кальция CaSeO3 в виде группы бесцветных ромбов. Соли стронция при действии этого реактива выпадают в виде мелкозернистого осадка, соли бария кристаллизуются в виде сегментов. [8]
К раствору соли кальция прибавляют раствор трехзамещенной калиевой соли нитрилтриуксусной кислоты. [9]
При соприкосновении раствора соли кальция, содержащей радиоактивный изотоп Са45, с почвой, насыщенной кальцием, радиоактивность раствора понижается вследствие того, что радиоактивный кальций равномерно распределяется между раствором и кальцием, находящимся в поглощенном состоянии. Зная содержание кальция в растворе и измерив его радиоактивность, по разности в радиоактивности исходного и равновесного раствора рассчитываем содержание кальция в поглощенном состоянии. Этот простой расчет сразу дает количество кальция в поглощенном состоянии, способного к обмену. [10]
Результат взаимодействия растворов солей кальция с жидким стеклом заключается в коагуляции силикатного раствора. Состав выпавшего аморфного осадка существенно зависит от того, что к чему приливали, от интенсивности перемешивания, от концентрации используемых растворов, от рН образовавшейся реакционной смеси и может включать в себя как гидроокиси кремнезема и кальция, так и силикаты кальция с захваченными ионами хлора. Такой характер взаимодействия наблюдается с большинством солей двухвалентных металлов. О нем очень часто говорят как о соосаждении гидроокисей металла и кремния, об адсорбции гидроокиси металла на коллоидном кремнеземе или, наоборот, об осаждении кремнезема на окислах и гидроокисях металлов. В очень разбавленных растворах с рН8 - 10 взаимодействие реагентов может проявляться в виде опалесценции, появляющейся через часы или сутки после смешения растворов. [11]
Остающиеся в растворе соли кальция выпадают в осадок при добавлении соды. [12]
В пробирки наливают растворы солей кальция, стронция и бария. В каждую пробирку добавляют 1 - 2 мл раствора хромата калия. Образуются ли осадки, какой их цвет. Растворимы ли осадки в уксусной кислоте. [13]
К 1 мл раствора соли кальция ( 0 002 - 0 02 г иона кальция) прибавляют 1 мл раствора оксалата аммония; образуется белый осадок, нерастворимый в разведенной уксусной кислоте и растворе аммиака, растворимый в разведенных минеральных кислотах. [14]
Ус - объем раствора солей кальция и магния, мл; VT - объем раствора трилона Б, мл. [15]
Страницы: 1 2 3 4