Раствор - соль - двухвалентный марганец
Cтраница 1
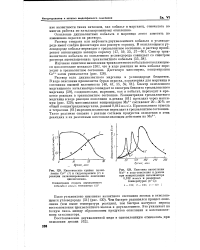 |
Кинетические кривые накопления Со3 ( Т и гидроперекиси ( 2 в реакции катализированного окисления циклогексана.| Кинетика накопления. [1] |
Раствор соли двухвалентного марганца в углеводороде бесцветен. Спектр окисленного марганцевого катализатора совпадает со спектром бензоата трехвалентного марганца [59], следовательно, марганец, как и кобальт, переходит в процессе реакции в трехвалентное. При окислении кумола и тетралина [61 ] марганец полностью переходит в трехвалентное состояние. [2]
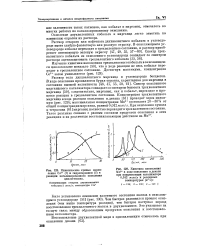 |
Кинетические кривые накопления Со3 ( 1 и гидроперекиси ( 2 в реакции катализированного окисления циклогексана.| Кинетика накопления. [3] |
Раствор соли двухвалентного марганца в углеводороде бесцветен. Спектр окисленного марганцевого катализатора совпадает со спектром бензоата трехвалентного марганца [59], следовательно, марганец, как и кобальт, переходит в процессе реакции в трехвалентное состояние. При окислении кумола и тетралина [61] марганец полностью переходит в трехвалентное состояние. [4]
Электролизом растворов солей двухвалентного марганца на аноде отлагается диоксид марганца. При действии восстановителей он проявляет окислительные свойства. [5]
Если из раствора соли двухвалентного марганца, полученного растворением металлического марганца, требуется получить стандартный раствор перманганата, то его окисляют, добавляя к раствору 1 г периодата калия KJO4, и кипятят 10 - 15 мин. Охлажденный окрашенный раствор разбавляют до 1 л водой в мерной колбе. [6]
Получается электролизом растворов солей двухвалентного марганца. [7]
Кроме раствора мышьяковистокислого натрия можно также пользоваться раствором соли двухвалентного марганца, титр которого устанавливают таким же способом, как указано выше. [8]
Для проведения этой реакции вносят в пробирку 1 каплю раствора соли двухвалентного марганца, прибавляют 2 - 3 мл. Раствор тотчас же окрашивается л фиолетовый цвет Хлориды и другие восстановители должны быть предварительно удалены. [9]
Сульфид марганца MnS получают в виде красного осадка при обработке растворов солей двухвалентного марганца сульфидом аммония. При хранении в растворе сульфида аммония, а еще быстрее при нагревании в нем ( гидратированный) сульфид марганца ( П) переходит в более устойчивую зеленую форму. Сульфид марганца ( П) триморфен и кристаллизуется в решетке NaCl, вюрцита и цинковой обманки. Последний соответствует зеленой форме и содержится в минерале алабандине. [10]
Гидроксид марганца ( IV) получается или осаждением щелочами из растворов солей двухвалентного марганца в присутствии окислителей, например, хлорной извести, кислорода и др., или же восстановлением соединений высшей валентности марганца в нейтральной среде. Гидроксид представляет собой хлопьевидный осадок буро-черного цвета. Он отличается более сильной активностью сравнительно с диоксидом марганца, поэтому применяется как окислитель значительно чаще, например, при производстве красителей. [11]
Гидрат закиси марганца Мп ( ОН) 2 получают действием щелочей на растворы солей двухвалентного марганца. Он имеет основной характер. [12]
Как известно, примеси щелочных ( Na, Б) и щелочноземельных элементов ( Са, Мд), сопутствующие марганцу в исходном сырье, при вислотном извлечении переходят в раствор одновременно с марганцем и при последующей переработке растворов солей двухвалентного марганца загрязняют готовый продукт, ухудшая его качество. [13]
Как катион марганец встречается чаще всего в соединениях двухвалентного марганца. Растворы солей двухвалентного марганца окрашены в бледно-розовый цвет. [14]
Предполагают, что в процессе окисления железа возникают его активные формы ( наиболее вероятно - соединения пятивалентного железа), которые, собственно, и окисляют хлориды до свободного хлора. Это достигается введением в раствор солей двухвалентного марганца и смеси фосфорной и серной кислот. По-видимому, Мп ( II) играет роль своеобразного катализатора или регулятора химической реакции между перманганатом и двухвалентным железом и направляет ее по строго определенному пути. [15]
Страницы: 1 2