Раствор - соль - цинк
Cтраница 2
В растворе соли цинка подвергаются сильному гидролизу и показывают кислую реакцию. Хлористый цинк даже нельзя получить из раствора в совершенно безводном виде: при выпаривании образуются основные соли. [16]
Пусть имеется раствор соли цинка, содержащий незначительную примесь соли кадмия. Из ряда напряжений металлов известно, что металлический цинк вытесняет кадмий из его солей. [17]
Пусть имеется раствор соли цинка, содержащий незначительную примесь соли кадмия. Из ряда напряжений металлов известно, что металлический цинк вытесняет кадмий из его солей. Если опустить цинковую пластинку в раствор соли кадмия, часть атомов цинка перейдет в раствор в виде положительных ионов, а цинковый электрод приобретает отрицательный заряд за счет освободившихся электронов. Электроны переходят также на платиновый электрод и на нем начнут разряжаться ионы кадмия, находящиеся в растворе. Кадмий может осаждаться также непосредственно на цинковой пластинке. Это явление называют цементацией. Однако на платиновом электроде разряд ионов кадмия значительно облегчается. [18]
 |
Кристаллы Zn [ Hg ( SCN4 ]. [19] |
К капле раствора соли цинка, подкисленного СН3СООН и нагретого, прибавляют на предметном стекле каплю раствора ( NH4) a [ Hg ( SCN) 4 ] и рассматривают образовавшиеся кристаллы Zn [ Hg ( SCN) 4 ] под микроскопом. [20]
При электролизе растворов солей цинка не должно было бы происходить выделение металла, так как цинк имеет значительно более высокий электродный потенциал, чем водород. По теоретическим соображениям, однако, для выделения водорода на цинковом электроде необходим дополнительный потенциал, который называют перенапряжением. Перенапряжение водорода на цинковом электроде столь велико, что в первую очередь происходит выделение цинка, а не водорода. В реальных условиях эти процессы происходят параллельно, в результате чего водород нарушает кристаллическую структуру цинка вследствие проникновения внутрь кристаллов выделяющегося металла и внедрения как в массу кристаллов, так и между кристаллами цинка. В обоих случаях прочность металла падает и он приобретает хрупкость. [21]
При обработке растворов солей цинка аммиаком сначала осаждается Zn ( OH) 2, который затем растворяется в избытке аммиака с образованием солей приведенного выше комплексного иона. [22]
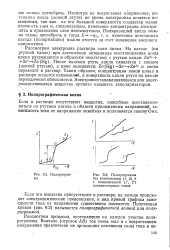 |
Подпрограммы без компенсации ( 1 2 и с компенсацией (., 2 конденсаторных токов. [23] |
Рассмотрим электролиз раствора соли цинка. Zn ( Hg) - 2e - - Zn2 и снова переходит в раствор. Таким образом, концентрация ионов цинка в растворе остается неизменн й, а поверхность капли ртути на катоде периодически обновляется. Электровосстанавливающееся или элект-роокисляющееся вещество принято называть деполяризатором. [24]
Получается электролизом растворов солей цинка. [25]
К-1 объем раствора соли цинка, соответствующий 1 мл раствора гексацианоферрата ( II) калия, мл; а - объем раствора соли цинка, израсходованного на обратное титрование при анализе пробы, мл; 3 - содержание цинка в 1 мл раствора сульфата цинка, мг; V - объем анализируемой сточной воды, мл. [26]
Если к раствору соли цинка добавить по каплям раствор щелочи, то образуется осадок. Этот осадок растворяется в избытке щелочи и в растворе кислоты, при добавлении раствора аммиака. [27]
Если к раствору соли цинка, например ZnSO4, прилить раствор: а) КОН; б) KCN, то образующийся вначале осадок растворяется. Какие при этом происходят реакции. [28]
При титровании раствором соли цинка определению германия мешают магний, щелочноземельные и все металлы, образующие комплексонаты в аммиачной среде. Не мешают 100 лег мышьяка, до 10 мг сурьмы и до 15 мг молибдена. [29]
Пиридин с растворами солей цинка как при нагревании, так и на холоду дает белый аморфный осадок гидрата окиси цинка; осаждение при этом неколичественное. Свойство хлористо-пиридинового комплекса легко растворяться при нагревании было использовано нами для1 отделения цинка от железа, алюминия и хрома. Изучая условия отделения этих металлов, мы, на основании наших предыдущих работ о применении пиридина, осаждали железо, алюминий и хром пиридином в присутствии хлористого аммония, стремясь создать условия для наиболее полного перехода цинка в раствор. При проведении опытов определялось количество цинка, захваченное осадками полуторных окислов. [30]
Страницы: 1 2 3 4