Раствор - исходная соль
Cтраница 1
Растворы исходных солей в реакции ( 1), вследствие гидролиза последних, имеют различные значения рН: раствор олеиновокислого натрия имеет щелочную реакцию, а раствор сульфата хрома кислотную. [1]
В процессе пропитывания носителя раствором исходных солей на его поверхности должно отложиться промежуточное вещество, разложение которого приводит к образованию активной фазы катализатора. [2]
В стакан вместимостью 1 л вводят раствор исходной соли свинца, включают механическую мешалку и при интенсивном перемешивании при 20 - 30 С приливают из капельной воронки в - Течение 10 - 15 мин хромовую смесь. При этом через каждые 1 - 2 мин контролируют рН среды с помощью рН - метра или индикаторной бумаги, поддерживая значение рН 3 - 4 путем добавления по каплям 5 % - ного раствора соляной кислоты или карбоната натрия. [3]
Часто утверждают, что двойные соли растворяются вновь с образованием растворов исходных солей, и в последнем случае раствор содержит комплексные ионы, не присутствующие в этих солях. Однако неразумно различать два вида твердых веществ на основании их поведения в растворе, так как в предыдущей главе было уже показано, что между структурой твердого тела и формой существования того же соединения в растворе нет простой зависимости. С одной стороны, комплексный ион может существовать в кристалле, но будет неустойчив в растворе, и твердое тело, представляющее собой настоящую комплексную соль, может давать в растворе все реакции простых ионов. Название комплексная соль лучше сохранить для всех кристаллических солей, содержащих комплексные ионы, не существующие в кристаллах тех простых солей, из которых они были приготовлены. [4]
Синтез высокоинтенсивной железной лазури отличается от синтеза низкоинтенсивного пигмента концентрацией растворов исходных солей и способом осаждения и обработки белого теста. [5]
Для определения констант устойчивости и стехиометрических составов комплексных соединений измеряют электропроводность растворов исходных солей М А и RXm, затем смешивают их и измеряют электропроводность полученных после смешения растворов. Обычно используют при этом два приема, которые получили названия прямого метода и метода непрерывных изменений. [6]
Точка О, лежащая на пересечении диагоналей, соответствует эквивалентному содержанию в растворе исходных солей. [7]
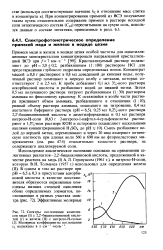 |
Спектры поглощения комплексов меди ( I с 2 2 -бицинхониновой кислотой ( 1 и железа ( II с нитрозо - Н - солью ( 2. Молярные коэффициенты поглощения ЕЪ выражены в л-см 1-моль 1. [8] |
При концентрировании примесей из ВСЭ получаемое таким путем относительное содержание примеси в растворе исходной соли эвтектического состава ( C0s) пересчитывали на сухую соль, используя данные о составе эвтектики, приведенные в разд. [9]
Оранжевые крона синтезируют из двухосновного ацетата свинца и хромовой смеси. Раствор исходной соли свинца в стакане вместимостью 500 мл нагревают на водяной бане до 80 - 90 С и при непрерывном перемешивании механической мешалкой медленно приливают из капельной воронки хромовую смесь. [10]
Бром выделяется из раствора исходной соли в виде тяжелой жидкости, иод - в твердом состоянии. [11]
В работе [457] описан метод получения солей ЧАО ( на примерах солей тетраметиламмония) в трехкамерном электродиализаторе с ионообменными мембранами. В крайние камеры помещаются растворы исходной соли ЧАО и неорганической соли, содержащей анион целевого соединения, образующегося в средней камере. [12]
В работах [ 516 - 518J описан синтез солей лития и натрия из ТФБ калия или аммония в среде ацетона, который для улучшения кинетики ионного обмена разбавляют водой ( до 25 объемн. Растворимость в чистом ацетоне при 25 С следующая: 6 вес. Рекомендуется использовать 2 5 % - ный раствор исходной соли и проводить синтез с помощью катионита КУ-2 в Li - или Na-форме соответственно. Коэффициенты обмена R ( Li, Na) - ТФБ ( К, NH4) как в неводных полярных растворителях, так и в воде, больше 1 ( например, на КУ-2 в ацетоне KLI K 3 8; АГи мн4 3 5), поэтому прямой выход чистых солей лития и натрия по ТФБ-иону в динамических условиях близок к теоретическому. [13]
Страницы: 1